未折叠或错误折叠蛋白的聚集是许多神经退行性疾病的一种标志,会导致能使神经元细胞产生细胞毒性的神经纤维缠结和斑块。人们越来越关注于了解已知会形成这些聚集物的蛋白产生和加工所需的机制这一领域,因为这些蛋白聚集物与阿尔茨海默病、帕金森病、亨廷顿氏舞蹈病和肌萎缩性脊髓侧索硬化症有关。靶向蛋白聚集物形成的新疗法开发面临的一些挑战包括:对作用机制的认识不全面,以及缺少早期诊断病情、监视疾病进展和治疗效果的生物标记物。
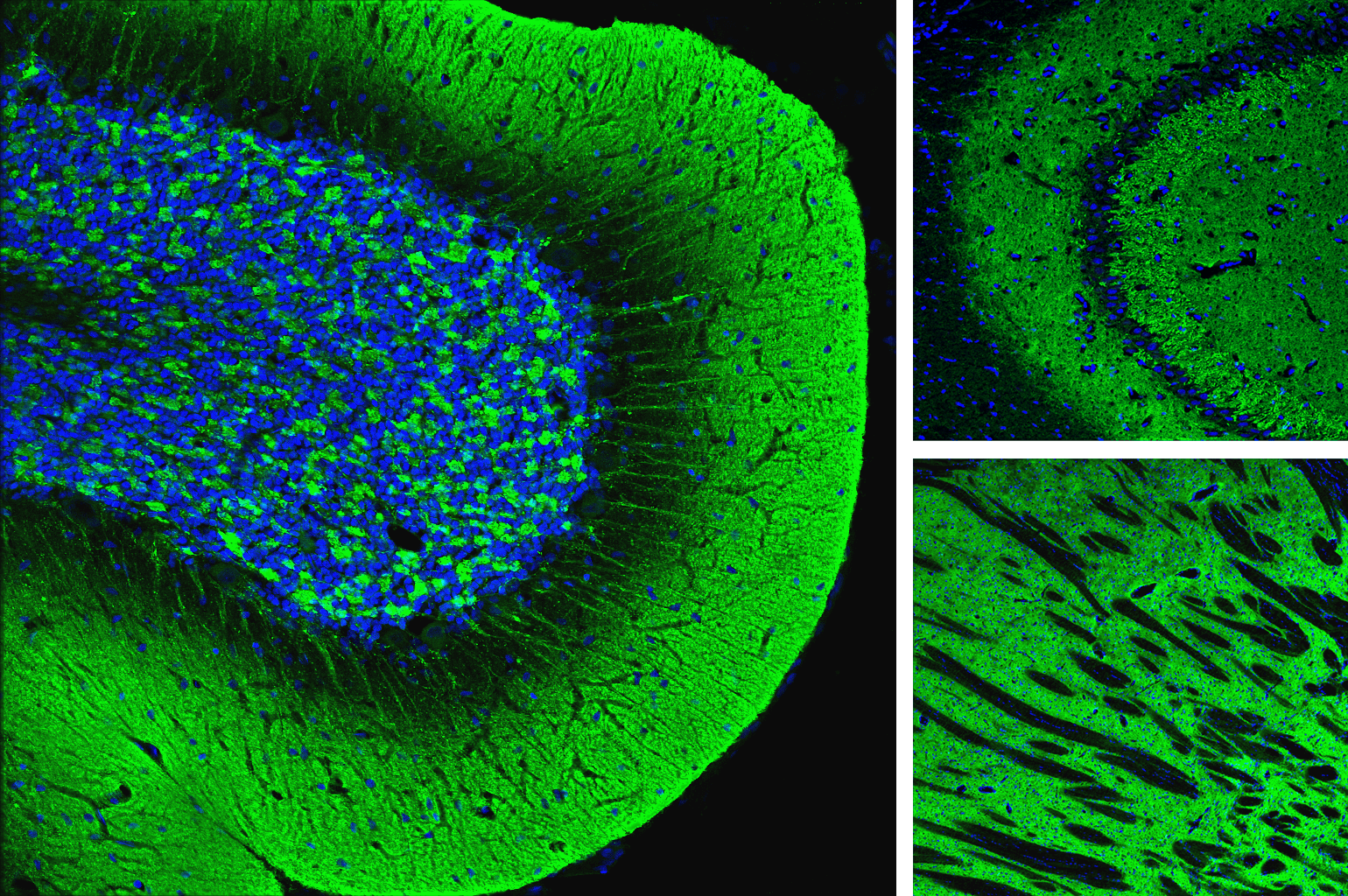
β-淀粉样蛋白 (Aβ) 是一种肽,它是在阿尔茨海默病患者的脑细胞中观察到的淀粉样斑块的主要组分。当淀粉样前体蛋白 (APP) 被 β-分泌酶和 γ-分泌酶裂解时,会形成肽。
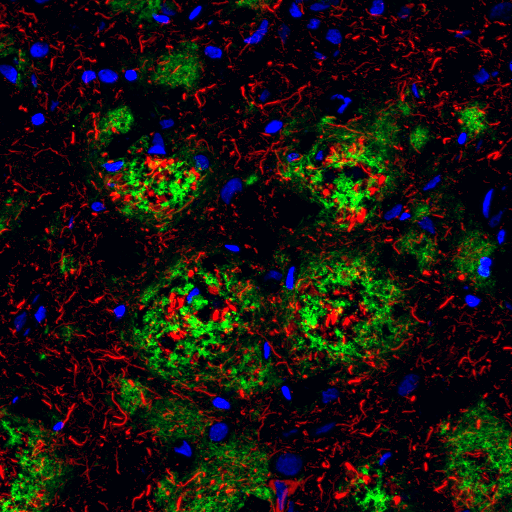
在正常细胞条件下,Tau 会促进并稳定微管组装,尤其是在轴突中。在神经纤维缠结中,Tau (Thr205) 磷酸化的特征很明确,在阿尔茨海默病的早期水平较低,在晚期水平显著更高。
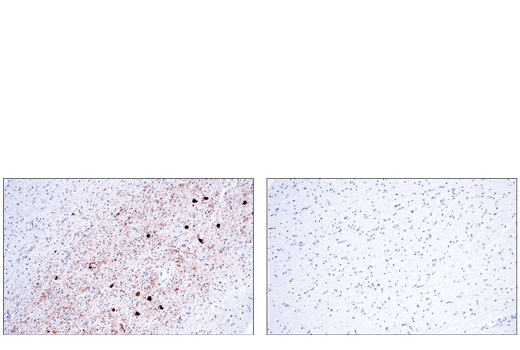
对 α/β-突触核蛋白的关注始于在患有常染色体显性帕金森病的几个家族中观察到突变。α/β-突触核蛋白可调节膜稳定性和/或更新;但其正常的细胞功能尚未被最终确定。α/β-突触核蛋白突变与早发型家族性帕金森病有关。