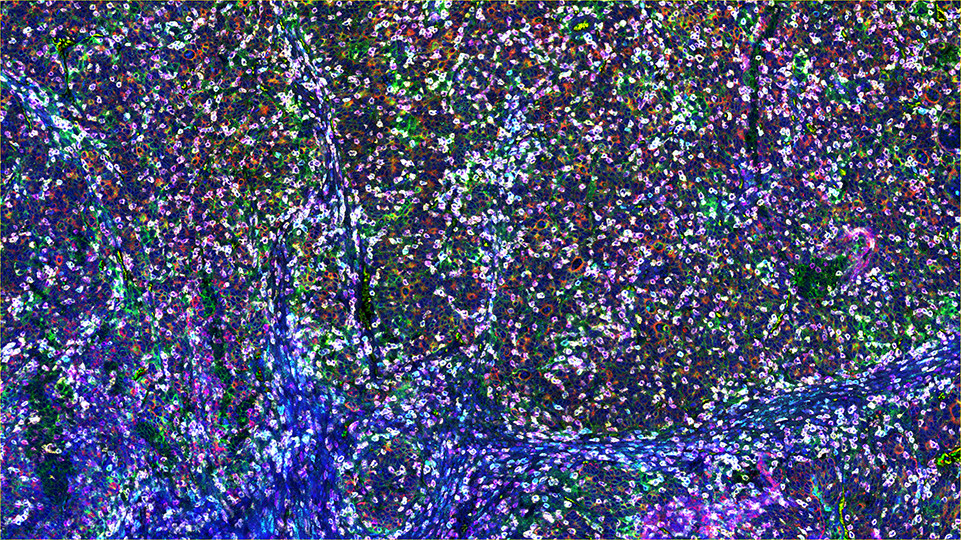 |
储存:所有试剂盒组分都储存于 -20ºC。 稳定性:在建议的温度保存时,该试剂盒中所有组分均稳定至少 12 个月。不得超过 5 次冻/融循环。 应用:SignalStar 试剂盒适用于进行荧光多重免疫组织化学分析。 载玻片数目:该试剂盒包含足够着染 10 张载玻片的材料。 |

SignalStar 多重免疫组织化学 (mIHC) 是一种采用抗体、寡核苷酸 (oligos) 和荧光团探究细胞存在情况、位置、功能和生物标记物共表达模式的技术。SignalStar 技术使得在维持空间背景和组织结构的同时检测多个表型靶标与功能靶标成为可能。洞悉这些对了解细胞如何组织并相互作用以影响组织微环境及推动疾病进展和对治疗作出反应至关重要。
SignalStar 系统的力量存在于 SignalStar 抗体设计中。这些抗体已就用于福尔马林固定、石蜡包埋 (FFPE) 的组织中经过严格验证,并且随后使用位点特异性偶联和彻底纯化方法偶联至唯一寡核苷酸标签。使用高度特异的互补性寡核苷酸和荧光团网络,科学家可以放大 3-8 种靶标的信号,即使这些靶标处于低丰度亦如此。
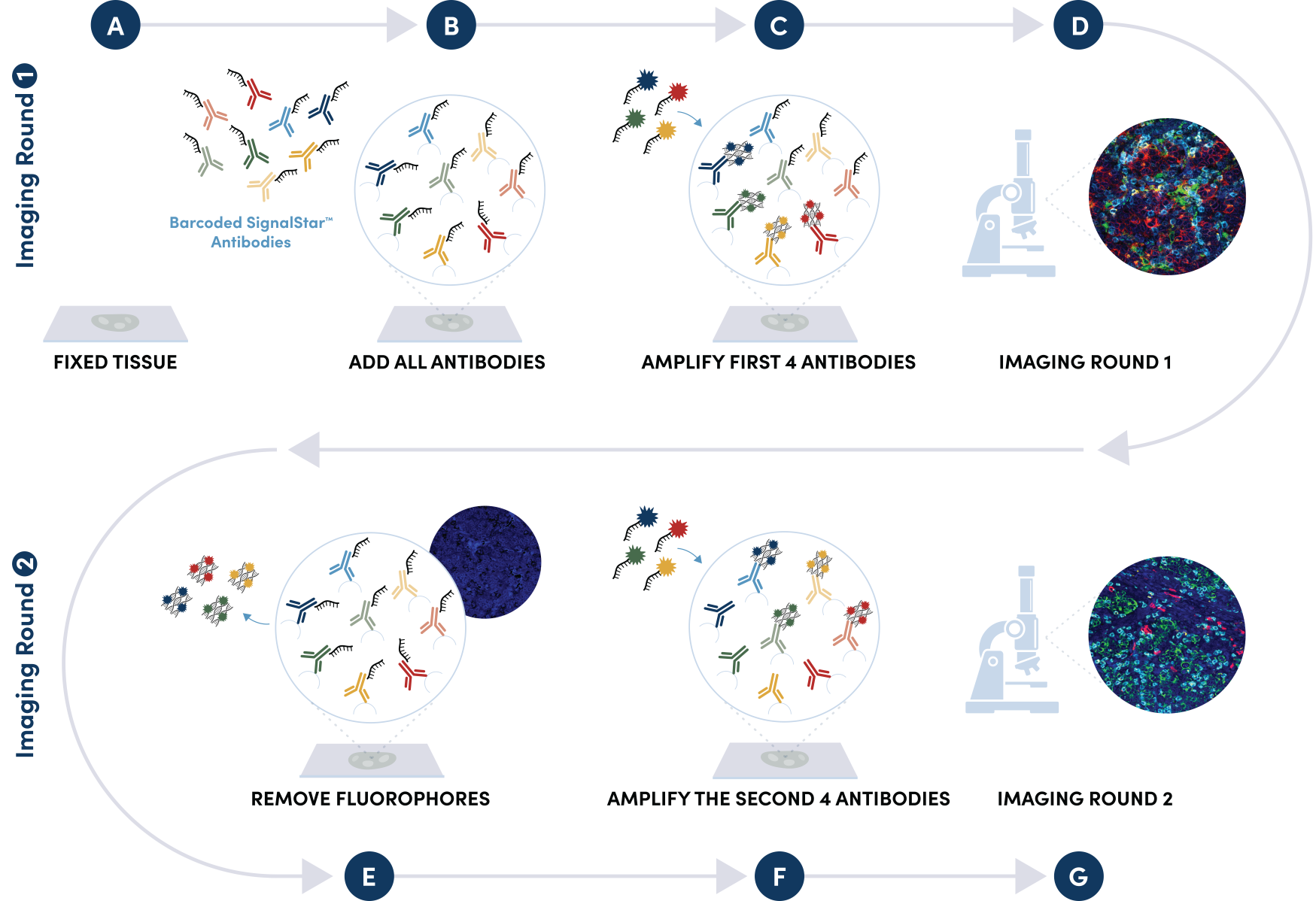
图 1. 将您所选像素尺寸(最多 3-8 种唯一寡核苷酸偶联抗体)下的所有抗体按混合物添加于一个初级孵育步骤中。带荧光染料(信道:488、594、647 和 750)的互补性寡核苷酸通过构造与抗体接合的寡核苷酸-荧光团结构体,在第一轮成像中放大多达 4 种寡核苷酸偶联抗体的信号。如果像素尺寸大于 4,则柔和移除第一轮的寡核苷酸和荧光团,并且进行第二轮放大以可视化多达 4 种额外的寡核苷酸偶联抗体;互补性寡核苷酸系统和使用荧光团移除过程使得从同一底物放大第二轮抗体成为可能,同时无交叉反应性。然后将 2 幅图像用专有或开源软件以计算方式对齐并融合,以生成由多达 8 种靶标组成的图像。
| 包含在 SignalStar™ 二抗试剂盒中的材料 |
| 多达 3 种 SignalStar 寡核苷酸偶联二抗(见下文) |
| 多达 3 种 SignalStar 互补性寡核苷酸(见下文) |
| 二级封闭同型对照抗体 |
| SignalStar™ Antibody Diluent A |
| SignalStar™ Antibody Diluent B |
| 包含在 SignalStar™ 多重 IHC 缓冲液试剂盒中的材料 |
| 多达 8 种 SignalStar 寡核苷酸偶联抗体(见下文) |
| 多达 8 种 SignalStar 互补性寡核苷酸(见下文) |
| SignalStar™ Antibody Diluent A |
| SignalStar™ Antibody Diluent B |
| SignalStar™ Amplification Buffer A |
| SignalStar™ Amplification Buffer B |
| SignalStar™ Amplification Oligo Set A: |
| 488 |
| 594 |
| 647 |
| 750 |
| SignalStar™ Amplification Oligo Set B: |
| 488 |
| 594 |
| 647 |
| 750 |
| SignalStar™ Ligation Buffer |
| T4 DNA 连接酶 (5 U/µL) |
| ATP (100 mM) |
| 10X dsDNase Buffer |
| dsDNase |
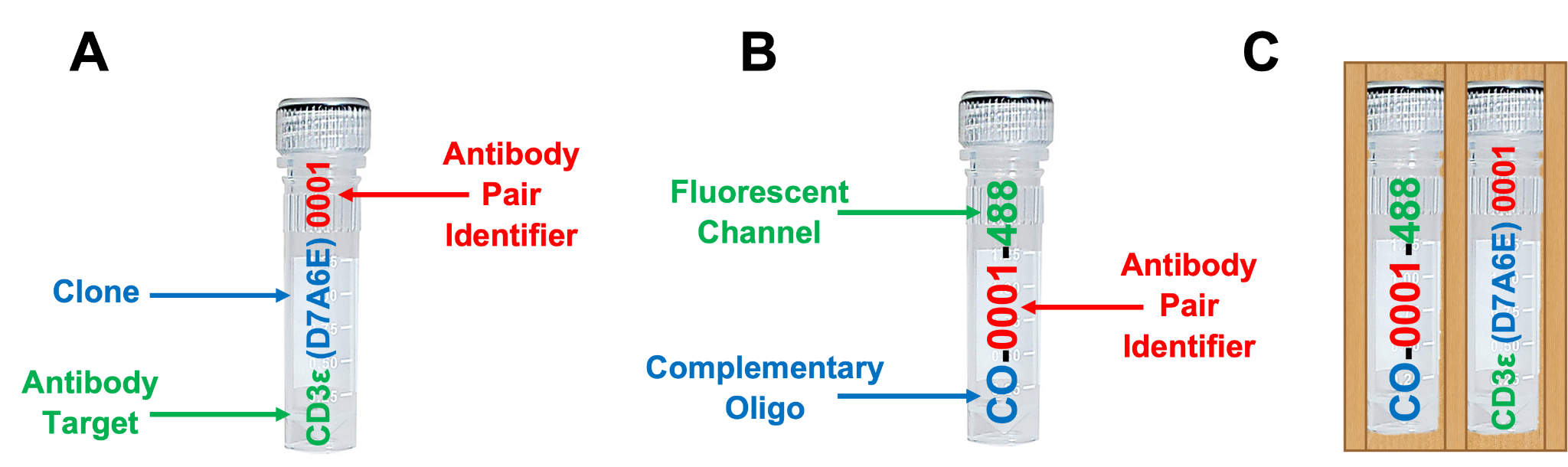
包括多达 8 种 SignalStar 寡核苷酸偶联抗体 (A) 和多达 8 种 SignalStar 互补性寡核苷酸 (B),它们在订购时选定并随各自寡核苷酸-抗体对 (C) 成套提供。请参见以下示例。
 |
在设置实验之前,请完整阅读溶液制备和实验步骤。 |
|||||||||||||||||||||||||
 |
请勿合并相同荧光信道的互补性寡核苷酸。 对于每个荧光信道,成像轮次可以含有仅 1 种互补性性寡核苷酸。切勿在相同成像轮次合并专属于相同荧光信道的互补性寡核苷酸,因为这会使分析结果不可解读。 |
|||||||||||||||||||||||||
 |
||||||||||||||||||||||||||
 |
切勿合并来自不同检验组合的抗体。 如果您同时运行多个检验组合,则必须为每个检验组合生成单独的抗体/互补性寡核苷酸混合物。 |
|||||||||||||||||||||||||
 |
SIGNALSTAR 试剂盒中的某些组分具有粘性。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
|||||||||||||||||||||||||
 |
在创建您的解决方案之前,使用 BOND RX 软件设置实验步骤和试剂。 创建容器、实验步骤和新的 BOND 研究检测系统。要求 BOND 研究检测系统运行此实验步骤。 |
|||||||||||||||||||||||||
 |
执行每轮 SignalStar 检测后,始终在 BOND RX 上进行吸液探针清洁。 |
|||||||||||||||||||||||||
 |
请确认您的 SignalStar 检验组合设计是否要求 2 轮成像。 利用本文档第 10.1 节和第 9.1 节中的 SignalStar 检验组合设计示例和 SignalStar 检验组合设计工作表,获取指导和帮助。 |
|||||||||||||||||||||||||
 |
确认您的显微镜可以检测此试剂盒中提供的荧光团。 成像时,除 DAPI 外,还存在 4 个需要采集的荧光信道。请联系您的仪器供应商以确认仪器设置。 |
|||||||||||||||||||||||||
|
||||||||||||||||||||||||||
 |
载玻片应在完成染色的 8 小时以内成像。 如果载玻片未在这个时间段以内成像,则荧光信号可能减弱。 |
|||||||||||||||||||||||||
 |
建议应通过将单张染色的载玻片对相同荧光信道成像,创建光谱库。 这将使得更好解混成为可能,以帮助最大限度降低光谱交叉干扰的可能性。 |
|||||||||||||||||||||||||
 |
建议使用 DAPI 浓缩物,而不是含 DAPI 的封固剂。 DAPI 亮染便利更好地对齐图像。 |
|||||||||||||||||||||||||
 |
如果对本实验步骤有任何偏离,则不保证结果。 SignalStar 实验步骤用指定的抗原修复步骤和染色步骤开发并优化。 |
|||||||||||||||||||||||||
 |
建议使用阳性对照载玻片。 每次运行中应纳入一种组织,其中生色性染色已经对该组织确认多重检验组合中存在所有靶标。 |
|||||||||||||||||||||||||
 |
建议应按 1:100 使用每种抗体。 但是,供应了足以按 1:50 或 1:200 稀释度使用的抗体试剂。 |
|||||||||||||||||||||||||
 |
以下 SignalStar 试剂盒组分可在使用前于 4℃ 下解冻过夜:
|
 |
在创建您的解决方案之前,使用 BOND RX 软件设置实验步骤和试剂。需要 BOND RX 软件 7.0 版或更高版本。 |
必须依赖 BOND RX 软件创建以下试剂用于 SignalStar 分析:
BOND 滴定容器
|
1. 一抗溶液 |
|
|
2. 二抗溶液 |
|
|
3. 二级封闭液 |
|
|
4. MARKER(= SignalStar 染色溶液) |
|
|
5. 放大液 1 |
|
|
6. 放大液 2 |
|
|
7. 连接溶液 |
|
|
8. 荧光移除液 |
BOND 7 mL 开式容器
|
9. 10% 中性缓冲福尔马林 |
|
 |
创建 10% 中性缓冲福尔马林试剂时选择“危险”,以确保妥善处置废物。 |
BOND 30 mL 开式容器
|
10. 0.1X TBST |
|
|
11. 1X TBST(连接于 BOND 研究检测系统所需) |
|
1. 创建一个名为“CST SignalStar”的新 BOND 研究检测系统。 |
|
|
2. 将含 1X TBST 的 30 mL 开式容器连接至 CST SignalStar BOND 研究检测系统。 |
|
 |
步骤 2 中开式容器必须明确命名(例如,“1X TBST”而不是“0.1X TBST”)。 |
|
1. 在 BOND RX 软件中,选择“实验步骤设置”选项卡。 |
||||
|
2. 选择“*IF 实验步骤”(确保 Leica 列于 “修改者”栏中)。 |
||||
|
3. 复制实验步骤并将其重命名为“CST SignalStar Secondary 第 1 轮成像”。添加缩写名称“CST Sec Rd1”。 |
||||
|
4. 选择“显示洗涤步骤”。 |
||||
|
|
|||
|
6. 选择“CST SignalStar”作为首选的检测系统。 |
||||
|
7. 选择“创建实验步骤”。 |
||||
|
8. 单击“保存”,然后单击“是”以确认警告消息。 |
||||
|
9. 创建“CST SignalStar Secondary 第 1 轮成像”实验步骤的副本。 |
||||
|
10. 将副本名称更改为“CST SignalStar Secondary 第 2 轮成像”,缩写名称为“CST Sec Rd2”。 |
||||
|
11. 选择“显示洗涤步骤”。 |
||||
|
||||
|
13. 选择“CST SignalStar”作为首选的检测系统。 |
||||
|
14. 选择“创建实验步骤”。 |
||||
|
15. 单击“保存”,然后单击“是”以确认警告消息。 |
 |
每种溶液都应新鲜制作并及时使用。请阅读 SignalStar 第 1 轮成像:在制作溶液之前,请完整阅读第 6 部分的使用实验步骤。 |
||||||||||||||||||||||||||||||||||||||||||||||
 |
除非另有说明,SignalStar 试剂盒组分应在使用前立即于室温下解冻,然后在使用时存放在冰上。 |
||||||||||||||||||||||||||||||||||||||||||||||
 |
必须在适当的 BOND RX 容器中或来自 BOND 滴定套件 (#OPT9049) 的插管中使用每种试剂,以便该分析正常运行。 请参阅下表,以了解在 BOND RX 自动染色机上执行 SignalStar 分析所需的容器或插管的数目。 |
||||||||||||||||||||||||||||||||||||||||||||||
 |
请勿过度填充开式容器。如果容器过度填充,BOND RX 自动染色机将认为容器是“空的”。 |
||||||||||||||||||||||||||||||||||||||||||||||
 |
为某些 SignalStar 溶液分配了多个容器。 当从一个容器移动到另一个容器时,BOND RX 软件会提醒您。这不会破坏实验步骤,并且不需要用户采取任何行动。 |
||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
 |
该试剂盒不包含一抗稀释剂和一抗。 请按照制造商提供的推荐稀释剂中的推荐稀释度使用一抗。确认最终体积与下表所列相符。 |
||||||||||||||
 |
购买一抗时,请确保其已验证可用于福尔马林固定、石蜡包埋的组织。 您可以在 www.cellsignal.com 上查看经过 IHC-P 验证的抗体的综合目录。 |
||||||||||||||
 |
如果使用多种一抗和二抗: 结合来自独特来源物种的所有一抗(例如,兔单克隆抗体、小鼠单克隆抗体和大鼠单克隆抗体)。请勿混合来自同一来源物种的一抗。 |
||||||||||||||
|
|||||||||||||||
 |
SIGNALSTAR 抗体稀释液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||
 |
如果使用多种一抗和二抗: 结合所有二抗和互补寡核苷酸,用于检测独特来源物种(例如,抗兔、抗小鼠和抗大鼠)。 |
||||||||||||||||||||
|
|||||||||||||||||||||
 |
SIGNALSTAR 抗体稀释液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
|||||||||||||||||
 |
如果使用多种一抗和二抗: 结合所有包含独特来源物种的二级阻断同型对照抗体(例如,兔单克隆抗体、小鼠单克隆抗体和大鼠单克隆抗体)。 |
|||||||||||||||||
|
||||||||||||||||||
 |
一旦配制,SignalStar Imaging Round 1 Solution 应含有(随试剂盒订购的多达 7 种)所有抗体(包括用于第 1 轮成像和第 2 轮成像的那些抗体)和用于第 1 轮成像的互补性寡核苷酸。利用本文档第 10.1 节和第 9.1 节中的 SignalStar 检验组合设计示例和 SignalStar 检验组合设计工作表,获取指导和帮助。 |
||||||||||||||||||||
 |
请勿合并相同荧光信道的互补性寡核苷酸。 请勿将第 1 轮成像和第 2 轮成像中的互补性寡核苷酸合并。 |
||||||||||||||||||||
 |
SIGNALSTAR 抗体稀释液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||
|
|||||||||||||||||||||
 |
SIGNALSTAR 放大液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。如果适用,则在 2 个滴定插管之间均匀分配。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||||||||
 |
对于 10 张载玻片运行,在 15mL 锥形管中补充总体积,转动 20 分钟,然后在 2 个滴定插管之间均匀分配。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
SIGNALSTAR 放大液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。如果适用,则在 2 个滴定插管之间均匀分配。 不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
将以下试剂合并于一个 BOND 滴定插管中。用封口膜覆盖并涡旋混合 10 秒。配制溶液时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||
|
|||||||||||||||||||||
|
 |
每种溶液都应新鲜制作并及时使用。请阅读 SignalStar 第 1 轮成像:在制作溶液之前,请完整阅读第 6 部分的使用实验步骤。 |
 |
可以在您开始实验前当天焙烘载玻片。 此步骤可使固体石蜡融化并使组织更好地粘附在载玻片上。 |
| 1. 将载玻片在 60°C 孵育至少 30 分钟。 |
 |
BOND RX 可以在下午进行设置,并在夜间完成运行,从而简化工作流程。 此步骤可使固体石蜡融化并使组织更好地粘附在载玻片上。 |
 |
立即启动 BOND RX 染色运行,请勿使用延迟启动。一旦染色完成,则载玻片可以搁在 BOND RX 自动染色机上过夜。 |
| 2. 在 BOND RX 软件中,创建研究并添加载玻片。 | |
3. “添加载玻片”时,使用以下选项在 BOND 上制备组织:
|
|
| 4. 选择“SignalStar Secondary 第 1 轮成像”作为实验步骤并选择“HIER ER2 40 分钟”用于每块载玻片。 | |
| 5. 打印标签,贴在载玻片上,并将载玻片添加到 BOND 载玻片托盘。 | |
| 6. 将 BOND 覆盖物置于在载玻片上,确保载玻片正确位于托盘中。 | |
 |
良好做法是确认 SignalStar Secondary 第 1 轮成像实验步骤中每个步骤都正确无误。 请使用第 9.2 节中的清单协助创建您的实验步骤。 |
 |
确保下面列出的选定 0.1X TBST 洗涤设置为“打开”。 如果洗涤未“打开”,则荧光信号可能变动不定或减弱。确认总共有 6 个 SignalStar Amplification Solution 1 步骤和 6 个 SignalStar Amplification Solution 2 步骤。 |
 |
确认散装 Bond 洗涤液容器为满,且废物容器为空。 |
| 7. 启动 BOND RX 运行。 | |
| 8. 从 BOND RX 自动染色机中取出载玻片并置入 0.1X TBST。 | |
| 9. 在 BOND RX 自动染色机上运行抽吸探针清洁。按照常规程序清洁覆盖物。 | |
| 10. 根据数据表说明,配制 DAPI #4083 溶液。 | |
| 11. 用 DAPI 溶液复染。 | |
| 12. 将载玻片浸没于 0.1X TBST 中 30 秒。 | |
| 13. 将载玻片用 ProLong Gold Antifade Reagent #9071 封装。 | |
| 14. 在 8 小时以内对载玻片成像。 | |
 |
一旦载玻片脱蜡或取下盖玻片,任何时候切勿让载玻片干透。 |
 |
一旦成像完成,就可以从载玻片移除荧光信号,从而可以进行另一轮成像。在第一轮成像之后尽快进行第 2 轮成像。 |
 |
每种溶液都应新鲜制作并及时使用。请阅读 SignalStar 第 1 轮成像:在制作溶液之前,请完整阅读第 8 部分的使用实验步骤。 |
||||||||||||||||||||||||||||||||||||||||||
 |
SIGNALSTAR 第 2 轮成像仅为要求两个成像轮次的抗体检验组合所需。利用本文档第 10.1 节和第 9.1 节中的 SignalStar 检验组合设计示例和 SignalStar 检验组合设计工作表,获取指导和帮助。 |
||||||||||||||||||||||||||||||||||||||||||
 |
除非另有说明,SignalStar 试剂盒组分应在使用前立即于室温下解冻,然后在使用时存放在冰上。 |
||||||||||||||||||||||||||||||||||||||||||
 |
必须在适当的 BOND RX 容器中或来自 BOND 滴定套件 (#OPT9049) 的插管中使用每种试剂,以便该分析正常运行。 请参阅下表,以了解在 BOND RX 自动染色机上执行 SignalStar 分析所需的容器或插管的数目。 |
||||||||||||||||||||||||||||||||||||||||||
 |
请勿过度填充开式容器。如果容器过度填充,BOND RX 自动染色机将认为容器是“空的”。 |
||||||||||||||||||||||||||||||||||||||||||
 |
为某些 SignalStar 溶液分配了多个容器。 当从一个容器移动到另一个容器时,BOND RX 软件会提醒您。这不会破坏实验步骤,并且不需要用户采取任何行动。 |
||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
 |
在 1 个 BOND 滴定插管中合并以下试剂。用封口膜覆盖并涡旋混合 10 秒。配制溶液时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并所有试剂合用于运行,应立即迅速 SignalStar 溶液。 |
|||||||||||||||||
|
||||||||||||||||||
 |
一旦配制,SignalStar Imaging 2 Solution 应仅含用于第 2 轮成像的互补性寡核苷酸。利用本文档第 10.1 节和第 9.1 节中的 SignalStar 检验组合设计示例和 SignalStar 检验组合设计工作表,获取指导和帮助。 |
|||||||||||||||||
 |
不向第 2 轮成像溶液添加 SIGNALSTAR 偶联物。 |
|||||||||||||||||
 |
请勿合并相同荧光信道的互补性寡核苷酸。 请勿将第 1 轮成像和第 2 轮成像中的互补性寡核苷酸合并。 |
|||||||||||||||||
 |
SIGNALSTAR 抗体稀释液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
|||||||||||||||||
|
||||||||||||||||||
 |
SIGNALSTAR 放大液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。如果适用,则在 2 个滴定插管之间均匀分配。不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
SIGNALSTAR 放大液粘稠。如果溶液未准确测量或未充分混合,荧光信号可能会变动不定或减弱。使用低留置移液器吸头将 SignalStar 试剂盒组分混合到 15 mL 锥形管中。缓慢移液以确保准确性。在室温下颠倒转动 20 分钟。如果适用,则在 2 个滴定插管之间均匀分配。不使用时,所有 SignalStar 试剂盒组分均储存于冰上。一旦合并,SignalStar 溶液应保存在室温并迅速使用。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
在 1 个 BOND 滴定插管中合并以下试剂。用封口膜覆盖并涡旋混合 10 秒。配制溶液时,所有 SignalStar 试剂盒组分均储存于冰上。一旦已经合并所有试剂用于运行后,应迅速使用 SignalStar 溶液。 |
||||||||||||||||||||
|
|||||||||||||||||||||
|
 |
每种溶液都应新鲜制作并及时使用。请阅读 SignalStar 第 1 轮成像:在制作溶液之前,请完整阅读第 8 部分的使用实验步骤。 |
 |
SIGNALSTAR 第 2 轮成像仅为要求两个成像轮次的抗体检验组合所需。利用本文档第 10.1 节和第 9.1 节中的 SignalStar 检验组合设计示例和 SignalStar 检验组合设计工作表,获取指导和帮助。 |
| 1. 采集 SignalStar 第 1 轮成像的图像后,将载玻片浸泡于 dH2O 中 >30 分钟,以轻柔取下盖玻片。 | |
 |
一旦载玻片脱蜡或取下盖玻片,任何时候切勿让载玻片干透。 |
 |
BOND RX 可以在下午进行设置,并在夜间完成运行,从而简化工作流程。 此步骤可使固体石蜡融化并使组织更好地粘附在载玻片上。 |
 |
立即启动 BOND RX 染色运行,请勿使用延迟启动。一旦染色完成,则载玻片可以搁在 BOND RX 自动染色机上过夜。 |
| 2. 在 BOND RX 软件中,创建研究并添加载玻片。 | |
3. “添加载玻片”时,使用以下选项在 BOND 上制备组织:
|
|
| 4. 选择“CST SignalStar Secondary 第 2 轮成像”,确保将载玻片准备选为“--”并且将 HIER 选为“--”。 | |
| 5. 打印标签,向载玻片添加标签,并将载玻片置于 BOND 载玻片托盘上。 | |
| 6. 在添加 BOND 覆盖物之前,将 2-3 滴 dH2O 滴到每块载玻片上。 | |
 |
重要事项:第 2 轮放大无需脱蜡和 HIER(抗原修复)。如果使用脱蜡和 HIER,则第 2 轮放大结果将不可解读。 |
 |
良好做法是确认第 2 轮成像实验步骤中每个步骤正确。 请使用第 9.3 节中的清单协助创建您的实验步骤。 |
 |
确保下面所列的选定 0.1X TBST 洗涤设置为“打开”。如果洗涤未“打开”,则荧光信号可能变动不定或减弱。确认总共有 6 个 SignalStar Amplification Solution 1 步骤和 6 个 SignalStar Amplification Solution 2 步骤。 |
 |
确认散装 Bond 洗涤液容器为满,且废物容器为空。 |
| 7. 启动 BOND RX 运行。 | |
| 8. 从 BOND RX 自动染色机中取出载玻片并置入 0.1X TBST。 | |
| 9. 在 BOND RX 自动染色机上运行抽吸探针清洁。按照常规程序清洁覆盖物。 | |
| 10. 根据数据表说明,配制 DAPI #4083 溶液。 | |
| 11. 用 DAPI 溶液复染。 | |
| 12. 将载玻片浸没于 0.1X TBST 中 30 秒。 | |
| 13. 将载玻片用 ProLong Gold Antifade Reagent #9071 封装。 | |
| 14. 在 8 小时以内对载玻片成像。 |
| 寡核苷酸偶联抗体 | 互补性寡核苷酸 | 产品对编号 | 。 | 488 | 594 | 647 | 750 |
(参见附录 10.1,了解检验组合设计示例)
| BOND 步骤 |
✓ | 试剂 | 步骤类型 | 孵育时间(分钟) | 温度 (C) |
分配类型 |
|---|---|---|---|---|---|---|
| 1 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 150 µL |
| 2 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 150 µL |
| 3 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 150 µL |
| 4 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 150 uL |
| 5 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 150 uL |
| 6 | ☐ | 一抗溶液 | 试剂 | 40:00 | 环境 | 150 uL |
| 7 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 8 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 9 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 10 | ☐ | 二抗溶液 | 试剂 | 40:00 | 环境 | 150 uL |
| 11 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 12 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 13 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 14 | ☐ | 二级封闭液 | 试剂 | 40:00 | 环境 | 150 uL |
| 15 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 16 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 17 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 18 | ☐ | 10% 中性缓冲福尔马林 | 试剂 | 5:00 | 环境 | 150 uL |
| 19 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 20 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 21 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 22 | ☐ | MARKER(第 1 轮成像溶液) | 主要 | 40:00 | 环境 | 150 µL |
| 23 | ☐ | 1X TBST 溶液 | 试剂 | 5:00 | 环境 | 打开 |
| 24 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 25 | ☐ | 10% 中性缓冲福尔马林 | 试剂 | 5:00 | 环境 | 150 µL |
| 26 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 打开 |
| 27 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 打开 |
| 28 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 150 µL |
| 29 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 30 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 31 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 32 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 33 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 34 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 35 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 36 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 37 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 38 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 39 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 40 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 41 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 42 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 43 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 44 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 45 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 46 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 47 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 48 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 49 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 50 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 51 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 52 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 53 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 54 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 55 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 56 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 57 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 58 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 59 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 60 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 61 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 62 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 63 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 64 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 65 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 66 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 67 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 68 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 69 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 70 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 71 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 72 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 73 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 74 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 75 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 76 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 77 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 78 | ☐ | 连接溶液 | 试剂 | 20:00 | 环境 | 150 µL |
| 79 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 80 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 81 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 82 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 83 | ☐ | BOND 洗涤液 | 洗涤 | 0:00 | 环境 | 150 µL |
| BOND 步骤 | ✓ | 试剂 | 步骤类型 | 孵育时间(分钟) | 温度 (C) | 分配类型 |
| 1 | ☐ | 0.1X TBST 溶液 | 洗涤 | 0:00 | 环境 | 打开 |
| 2 | ☐ | 0.1X TBST 溶液 | 洗涤 | 0:00 | 环境 | 打开 |
| 3 | ☐ | 荧光移除液 | 试剂 | 60:00 | 37° | 150 µL |
| 4 | ☐ | 荧光移除液 | 试剂 | 60:00 | 37° | 150 µL |
| 5 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 打开 |
| 6 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 打开 |
| 7 | ☐ | *去离子水 | 洗涤 | 0:00 | 环境 | 打开 |
| 8 | ☐ | MARKER(SignalStar 第 2 轮成像溶液) | 主要 | 40:00 | 环境 | 150 µL |
| 9 | ☐ | 1X TBST 溶液 | 试剂 | 5:00 | 环境 | 打开 |
| 10 | ☐ | 0.1X TBST 溶液 | 试剂 | 5:00 | 环境 | 打开 |
| 11 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 12 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 13 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 14 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 15 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 16 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 17 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 18 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 19 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 20 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 21 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 22 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 23 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 24 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 25 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 26 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 27 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 28 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 29 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 30 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 31 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 32 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 33 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 34 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 35 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 36 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 37 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 38 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 39 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 40 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 41 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 42 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 43 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 44 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 45 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 46 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 47 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 48 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 49 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 50 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 51 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 52 | ☐ | 放大液 1 | 试剂 | 8:00 | 环境 | 150 µL |
| 53 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 54 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 55 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 56 | ☐ | 放大液 2 | 试剂 | 16:00 | 环境 | 150 µL |
| 57 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 58 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 59 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 60 | ☐ | 连接溶液 | 试剂 | 20:00 | 环境 | 150 µL |
| 61 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 62 | ☐ | 0.1X TBST 溶液 | 试剂 | 0:00 | 环境 | 打开 |
| 63 | ☐ | BOND 洗涤液 | 洗涤 | 0:00 | 环境 | 150 µL |
| 寡核苷酸偶联抗体 | 互补性寡核苷酸 | 产品对编号 | 。 | 488 | 594 | 647 | 750 |
| Goat Anti-Rabbit IgG (H&L) Antibody | 互补性寡核苷酸 (CO-0055-488) |
30599 | 1 | ● | |||
| PD-L1 (E1L3N®) XP® Rabbit mAb (SignalStar™ Conjugate 0005) |
互补性寡核苷酸 (CO-0005-594) |
28249 | 1 | ● | |||
| TIM-3 (D5D5R™) XP® Rabbit mAb (SignalStar™ Conjugate 0010) |
互补性寡核苷酸 (CO-0010-647) |
15231 | 1 | ● | |||
| Ki-67 (8D5) Mouse mAb (SignalStar™ Conjugate 0014) |
互补性寡核苷酸 (CO-0014-750) |
56398 | 1 | ● | |||
| CD8ɑ (D8A8Y) Rabbit mAb (SignalStar™ Conjugate 0004) |
互补性寡核苷酸 (CO-0004-488) |
45747 | 2 | ● | |||
| CD68 (D4B9C) XP® Rabbit mAb (SignalStar™ Conjugate 0007) |
互补性寡核苷酸 (CO-0007-594) |
77318 | 2 | ● | |||
| CD20 (E7B7T) XP® Rabbit mAb (SignalStar™ Conjugate 0011) |
互补性寡核苷酸 (CO-0011-647) |
36775 | 2 | ● | |||
| Pan-Keratin (C11) Mouse mAb (SignalStar™ Conjugate 0003) |
互补性寡核苷酸 (CO-0003-750) |
97227 | 2 | ● |
如何验证 SignalStar Multiplex IHC 试剂盒和试剂?
CST 彻底验证了 SignalStar Multiplex IHC Panel Builder 菜单中可提供的每种抗体。通过滴定和荧光团配对以及在两轮成像中测试抗体的各种组合。对各种肿瘤和组织类型进行测试。我们还严格测试了传统显色测定法中使用的亲本抗体,因这些抗体充当这种荧光测定法的基础。我们无法测试所有多重配置或组织。如有任何疑问,请联系客户支持。
该测定法是否对冷冻组织有效?
尚未验证 SignalStar Multiplex IHC 试剂盒与试剂可用于冷冻的组织。我们正在验证我们的抗体和实验步骤是否可用于冷冻的组织。
你们是否有小鼠反应性抗体可提供?
是的,请在 SignalStar Multiplex IHC Panel Builder 的第一步中选择“小鼠”,以查看我们的小鼠反应性菜单。
我在你们的可提供抗体菜单中没看到我的目的靶标。我还能以某种方式在我的检测板中使用它吗?
尚未验证 SignalStar Multiplex IHC 试剂盒和试剂可配合我公司菜单以外的抗体使用。我们正在开发诸多定制解决方案以便在 SignalStar Multiplex IHC 测定法中使用您的自有抗体。
SignalStar mIHC 是一种无损技术。因此,为了使用目的抗体,您可以在 SignalStar 检测后对同一组织进行直接免疫荧光分析。SignalStar™ Fluorescence Removal Kit #32722 可让您在 SignalStar mIHC 后去除荧光寡核苷酸,以便对直接免疫荧光进行染色和可视化。
我能否将此检测中使用的抗体与直接偶联物组合?
尚未验证 SignalStar Multiplex IHC 试剂盒和试剂可与直接偶联物联合使用。SignalStar™ Fluorescence Removal Kit #32722 可让您在 SignalStar mIHC 后去除荧光寡核苷酸,以便对直接免疫荧光进行染色和可视化。我们发现,许多针对强细胞表面标记物的直接偶联物以这种方式使用时效果很好。请参阅我们去年春天在 AACR 上展示的最新海报,以了解更多信息。此外,请参阅我们用于直接免疫荧光成像的直接偶联抗体系列。
将我的 SignalStar 染色与系列切片上的生色性染色比较时,我看到更多阳性细胞。我如何知道这种过度染色是否正确?
在优化期间,我们发现荧光染色可能显示比显色性染色更高的阳性百分比。为确保任何过度染色为特异性,请确认用其他染色剂证明亚细胞定位和共定位正确。例如,如果所有 CD8+ 细胞都为 CD3+,则任何与显色性染色相比的 CD8+过度染色很可能是正确的。
完成染色后我可能等多久才对切片成像?
对于第 1 轮成像,在完成染色后 8 小时内成像时,染色应显示稳定信号。对于第 2 轮成像,成像应尽可能接近于染色完成时进行,但是应当保持稳定长达 8 小时。
我是否需要针对自己正在使用的组织类型优化 SignalStar Multiplex IHC 试剂盒和试剂?
SignalStar Multiplex IHC 试剂盒和试剂已针对抗体的荧光团配对和顺序作了优化。由于组织在靶标的质量和表达水平方面不同,将您的检验组合中抗体的浓度升高 2 倍或降低 0.5 倍可能有助在您的实验中实现最佳信号。
该测定法中应包括哪种适当的阳性对照?是否需要多个对照?
通过显色性 IHC 证明每个靶标呈阳性的任何组织都可以充当阳性对照组织。因此,每个靶标都将要求阳性对照,这有时可能导致多个对照必不可少。为了最佳比较,各切片应尽可能连续。
我是否可以使用除实验步骤中提供的方法以外的其他抗原修复方法?
为了获得最佳效果,我们不建议偏离 SignalStar 实验步骤。但如果您无法使用实验步骤中详述的抗原修复方法,您可以尝试使用微波炉,不过它已被证明会导致荧光信号减弱。我们不建议在检测低丰度靶标时使用微波炉,并且我们无法保证结果。
使用微波进行抗原修复:
配制 1X EDTA Unmasking Solution:要配制 250 ml 1X EDTA Unmasking Solution,将 25 ml SignalStain® EDTA Unmasking Solution (10X) (#14747) 用 225 ml dH2O 稀释。将载玻片浸入 1X EDTA Unmasking Solution 中,放入微波炉中加热直至沸腾(功率级别 10 下约 2.5 分钟)。随后在亚沸温度 (95°-98°C) 下煮沸 15 分钟。在大多数常见微波炉中,这相当于在功率等级 3 下加热 8 分钟,然后在功率等级 2 下加热 7 分钟。然后从微波炉中取出,将载玻片容器置于 dH2O 水龙头下,并将水直接添加到载玻片容器中,直至由 dH2O 替换所有 EDTA 为止。无需冷却。
我希望在具有高水平自发荧光的脂肪组织/大脑/正常肾脏组织上进行这项检测。你们是否可以提供任何示例数据以证明该检测方法适用于这种组织类型?
虽然我们在优化过程中使用了各种肿瘤和组织类型,但我们无法考虑所有组织和表达水平。假设遵循了我们推荐的实验步骤,该检测应适用于厚度为 4-5 µM 的 FFPE 组织。此外,由于该检测方法具有高水平的扩增,即使非常高的自发荧光水平也可通过产生强烈的特异性信号来克服。
我可以使用其他封固剂代替 ProLong Gold Antifade Reagent #9071 吗?
Prolong Antifade 封固剂是此实验步骤的最佳选择。内部测试表明,SlowFade 抗褪色试剂会对信号强度产生负面影响。
仅供研究使用。不得用于诊断流程。
Cell Signaling Technology、XP 和 SignalStar 均是 Cell Signaling Technology, Inc. 的商标。
E1L3N 是 Cell Signaling Technology, Inc. 的注册商标。Cy 和 CyDye 是 GE Healthcare 的注册商标。所有其他商标均属各自所有者专有。访问我们的商标信息页面。
© 2023 Cell Signaling Technology, Inc. 版权所有。
发布时间 2024 年 10 月