根据所研究的抗原靶标和所使用的应用,建议在抗体验证中采用补充策略。这些方法可以提供有关抗体特异性或功能性的重要信息,并可以根据靶标的生物学特性以及下游分析的确切要求进行精心定制。
补充策略包括使用肽阵列和/或 ELISA 确定抗体对翻译后修饰 (PTM) 的特异性,以及各种封闭肽方法来阻止抗体与特定抗原结合。实验步骤优化也包括在补充策略标志之内,包括中和作用或使用抗体作为激动剂激活蛋白质等各种功能检测。所有这些方法都提供了补充数据,以支持使用其他验证标志实验得出的结果。
磷酸化、乙酰化、甲基化、泛素化和磺酰化等 PTM 是蛋白变化的主要原因。由于蛋白质上存在的 PTM 的数量和类型可能决定结构和功能,因此研究人员需要高度特异的抗体来检测和定量这些修饰。
肽阵列和竞争性 ELISA 主要用于验证抗组蛋白修饰的抗体以及抗其他 PTM 的抗体,是确定 PTM 特异性并评估近端修饰对抗体特异性和敏感性影响的实用工具。通过提供同时评估多个 PTM 的能力,这些系统可以快速提供大量有价值的复用数据。
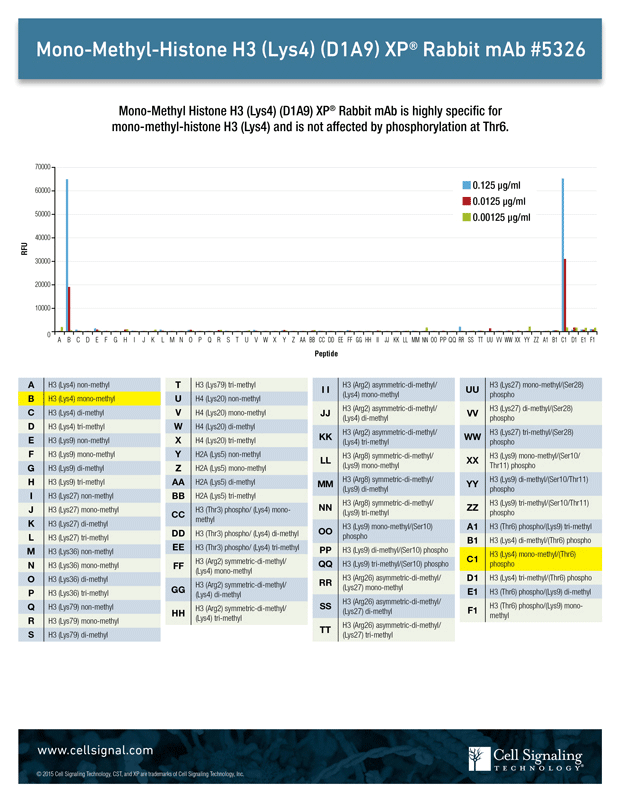
修饰的和未修饰的组蛋白尾肽阵列可用于验证抗体特异性。在图 1 中对此进行了说明,该图显示了使用这种阵列来筛选针对肽选择和修饰的 Mono-Methyl-Histone H3 (Lys4) (D1A9) 兔单克隆抗体。结果表明,该抗体不仅特异性检测组蛋白 H3 的乙酰化 4 位赖氨酸,而且附近修饰的存在(例如位 6 位丝氨酸的磷酸化)对抗体的特异性或功能性没有影响。
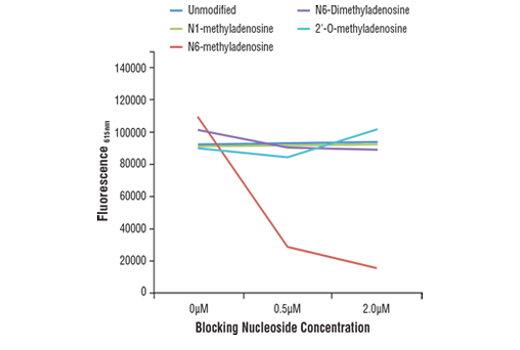
ELISA 还广泛用于评估抗体特异性,如图 2 所示。在这里,使用竞争性 ELISA 验证 N6-Methyladenosine (M6A) (D9D9W) Rabbit Mab。实现方式为在预先包被 m6A 寡核苷酸且存在不同修饰、浓度增加腺苷的微孔板中孵育抗体。结果表明,能与 m6A 结合的抗体仅可被游离的 m6A 封闭,这表明其靶标特异性。
在针对小分子或非蛋白质靶标的抗体验证过程中,至关重要的是确定抗体特异且灵敏地结合目标部分,而不检测任何生物类似物。这是因为脱靶结合会严重干扰任何实验结果,从而使任何数据都无效。在这些情况下,比较抗体对预期抗原和类似大小和形状的其他化合物的反应性是明智的,例如通过运行 ELISA 进行比较。
比 ELISA 更简单的方法是使用斑点印迹技术,其中针对已被印迹到膜上的样本筛选经过验证的抗体。该方法通常用作评估 PTM 抗体特异性的补充策略,如图3 所示。然而,重要的是要注意,尽管斑点印迹是测试抗体特异性的快速简便的方法,但对于任何相关数据,必须始终仔细考虑并严格控制实验设计。
图 3 显示了使用 293T 细胞制备的裂解物对 MAGE-A3 抗体进行的蛋白质印迹分析,其中 293T 细胞先采用表达各种带 Myc/DDK 标签的 MAGE 亚型载体进行转染。MAGE-A3 是一种在各种肿瘤细胞中经常表达的核蛋白,并且不是 293T 的内源性表达。这些数据说明了对 MAGE-A3 的抗体特异性,其中 DYKDDDK 抗体用于证明成功转染,而 β-肌动蛋白抗体用作上样对照。
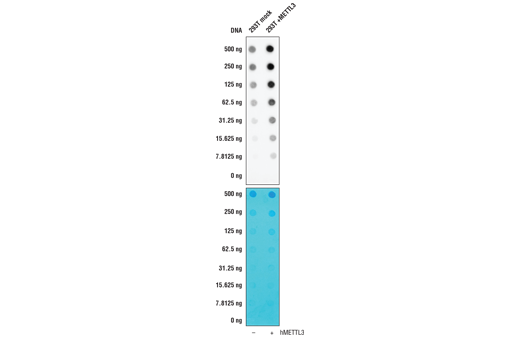
在该验证实验中,在存在或不存在可诱导 N6-甲基腺苷产生的蛋白 METTL3 表达的情况下,针对来自 293T 细胞的 RNA 检测前述相同的 N6-甲基腺苷 (m6A) (D9D9W) 兔单克隆抗体。抗体与靶标的结合明显受 METTL3 浓度的影响,从而可以确信其对靶标的特异性。
在肽竞争试验中,将经过验证的抗体与免疫肽一起孵育,然后再用于下游应用。理论,抗体结合肽将阻止检测抗原靶标。但是,决不能将肽竞争视为单独验证,因为肽抗原会阻断抗体与该抗体可结合的所有蛋白质的结合,甚至阻断与非特异性结合蛋白质的结合。重要的是将本手册中所述的其他验证策略与肽竞争测定法结合使用。
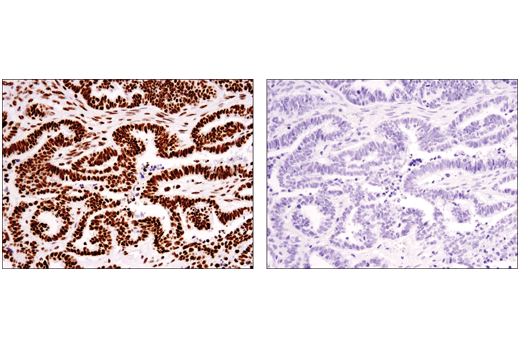
尽管如此,肽竞争确实可用于验证针对 PTM 的抗体,因为它可以直接将修饰的肽与未修饰的肽进行比较。图 4 显示了使用此方法通过免疫组织化学对 Tri-Methyl-Histone H3 (Ly36) (D5A7) 兔单克隆抗体的评估。用未修饰的肽(左)或三甲基封闭肽(右)孵育抗体后,对卵巢癌切片进行免疫组织化学分析。结果提供了支持性证据,证明抗体的染色对甲基修饰具有特异性。
本手册中,着重强调的是没有一种验证策略好于另一种验证策略,并且此处讨论的任何方法都不应孤立使用。每个基于抗体的应用均提供一组独特的条件,对于抗体的特异性、敏感性和功能性具有截然不同的难点。例如,通过蛋白质印迹显示出优良特异性的抗体在免疫组织化学测定中可能是非特异性的,或者在功能测定中是无效的。这强调了使用与预期模型系统中所需应用一致的策略和实验步骤验证每个单独抗体的重要性。
在 CST,我们采用此处描述的标志来确保对我们的抗体试剂充满信心,研究人员能够预期我们的抗体在应用中可正常发挥作用。最终,取决于我们产品的最终用户,以确保任何抗体都可以在预期的应用、实验步骤和模型系统中起作用。花时间分别优化每个实验系统对于产生精确的结果至关重要。