二元方法是评估抗体特异性的最佳方法之一。通过在生物学上相关的阳性和阴性表达系统中测试抗体,可以确认它在其天然环境中识别靶抗原,而不会与样品中存在的其他生物分子发生交叉反应。二元模型包括元靶标蛋白表达已知或预计为阳性(高)或阴性(低)的内源细胞或组织、基因敲除、诱导或抑制蛋白靶标的表达或修饰的处理。
为了使二元检测有效,应始终使用正交法验证数据,例如基因测序以确认敲除或蛋白质组分析,以验证表达水平。为抗体性能具有最大信心,还应采用其他验证策略。此外,用于抗体二元验证的每个模型应在预期使用抗体的每次应用中进行测试,只是因为抗体通过蛋白质印迹法检测具有特异性并不意味着它将通过免疫组织化学 (IHC) 检测具有特异性;该方法如下所示。
内源性表达重要靶标的细胞和组织是最简单的阳性对照形式。与未显示靶标表达的类似材料的样品平行使用时,它们对抗体的特异性抗原识别提供了快速“是/否”回答。
为确保该测试策略能提供有意义的理解,选择代表真阳性或阴性对照的样品材料很重要。这可以通过搜索文献,通过使用基因组学、转录组学或蛋白组学数据库,或通过比较测试抗体产生的免疫染色与同一靶标上不同抗原的经完全验证的抗体来实现。
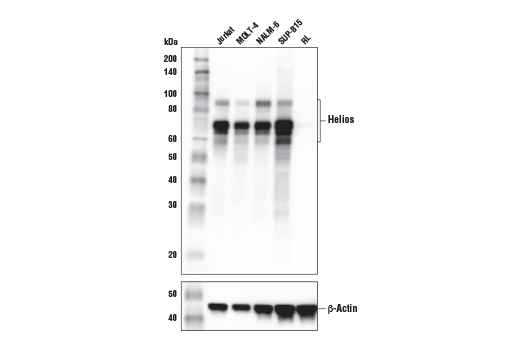
图 1 和 2 提供了使用内源性对照的抗体验证示例,强调应在每次预期应用中测试用于验证抗体的模型的概念。其中,图 1 显示 Jurkat 和 RL 细胞中的 Helios (E4L5U) rabbit mAb 的蛋白质印迹评估,其表达分别呈阳性和阴性,而图 2 显示同一细胞模型中抗体的免疫组织化学评价。如图所示,免疫组织化学和蛋白质印迹数据相互支持,上样控制确保样本(分析物)的质量不会导致对结果的曲解。

内源性二元模型并不总被采用,因为某些蛋白被普遍表达或支持表达的数据有矛盾或不可靠。在这些情况下,小鼠敲除模型是对抗体特异性进行二元评估所广泛使用的对照。通常由合作者提供,小鼠敲除样本包括野生型和敲除细胞和组织。它们表现出天然表达且不分别表达靶标抗原,且表现出理想的测试范例(若可用)。
实现基因敲除的另一种方法是使用 CRISPR 介导的基因中断,在简化为一种直观且高度灵活的系统后,这种技术在最近几年实用性大大增加。这种方法的优点在于,它在同一个细胞系中提供了阳性和阴性表达模型。但是,这种方法必须谨慎使用,因为基因中断不总是完全的,有时会产生截断或基因片段,可能导致信号产生。重要的是,应使用正交抗体独立策略来确认靶标敲低。此外,需要注意的是,细胞中的 CRISPR 敲除,尽管在细胞水平测定中关于抗体性能的信息非常丰富,不一定转化为组织水平测定,例如免疫组织化学法,其中存在多种细胞类型。
除了 CRISPR 介导的敲低,小型(或短型)干扰 RNA (siRNA) 是一种合成双链 RNA,常用于诱导蛋白质编码基因的短期沉默。另一个选择,短型或小型发夹 RNA (shRNA) 通常包含在 DNA 载体内,通过转染或病毒转导引入细胞。shRNA 表达引起的基因沉默,如果通过平衡载体的选择标记来选择转染或转导细胞,或者将 shRNA 稳定地集成到宿主基因组中,可能会延长沉默。
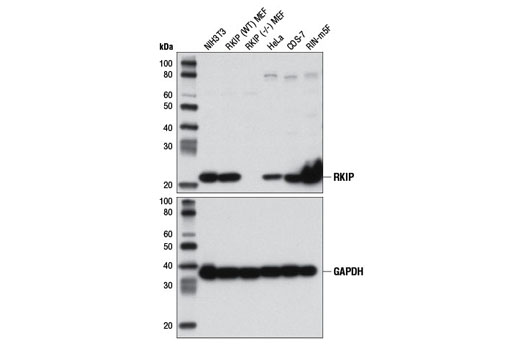
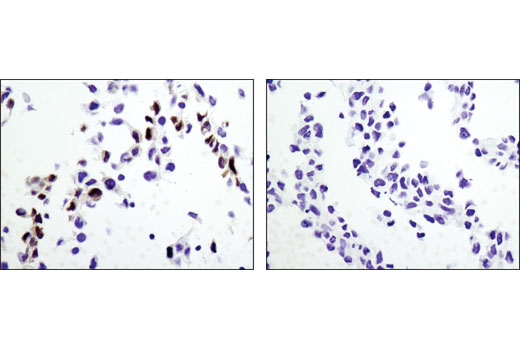
再次,在每次预期应用中独立检验用于抗体验证的基因敲除模型至关重要。图 3 和 4显示野生型 RKIP (D42F3) 兔 mAb 和 RKIP 敲除小鼠胚胎成纤维细胞 (MEF) 细胞的蛋白质印迹和免疫组织化学评估,图 5 和 6使用 Thymidine Kinase 1 (E2H7Z) 兔 mAB 阐明蛋白质印迹和免疫细胞化学分析,探测野生型或胸苷激酶 1 敲除 HCT116 细胞。如图所示,免疫组织化学和蛋白质印迹数据相互支持。


另一种形式的二元模型涉及通过治疗(激动剂或拮抗剂)来诱导或抑制蛋白靶标的表达、定位或翻译后修饰 (PTM)。这些治疗的结果为接近完全的阳性和阴性信号,它们可被视为二元验证。靶标抗原修饰是一种首选方法,用于验证对抗翻译后修饰靶标的抗体,例如磷酸化或乙酰化蛋白。
与任何验证技术一样,合适的加载和表达对照对于依赖于靶标抗原修饰的验证方法至关重要。它们用于确认治疗的疗效,并确保评估的样本同质同量。同样重要的是,治疗尽可能具有靶标特异性。例如,在使用更为普遍的处理方法,如非特异性地从广泛靶标中去除 PTM 的磷酸酶或脱乙酰酶,之前,应始终考虑蛋白或通道的特异性激动剂或抑制剂。
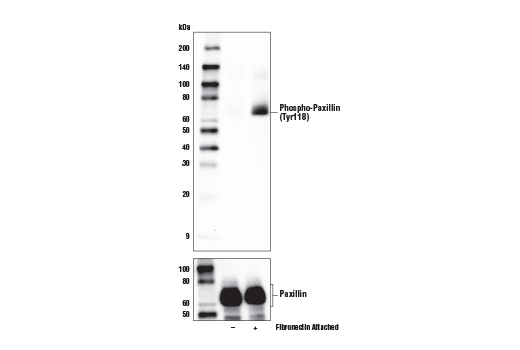
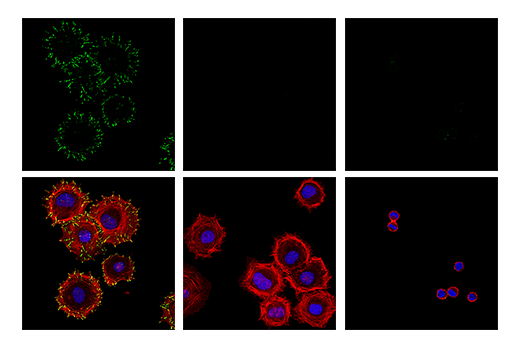
图 7 和 8显示在 Hela 细胞中对含磷酸化桩蛋白 (Tyr118) 抗体的验证,使用纤连蛋白表面涂层的细胞附着刺激酪氨酸残基磷酸化,导致诱导的免疫细胞化学标记。
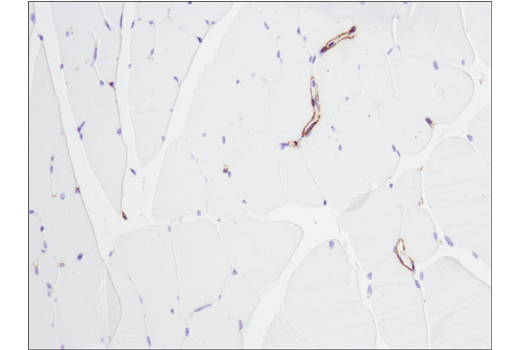
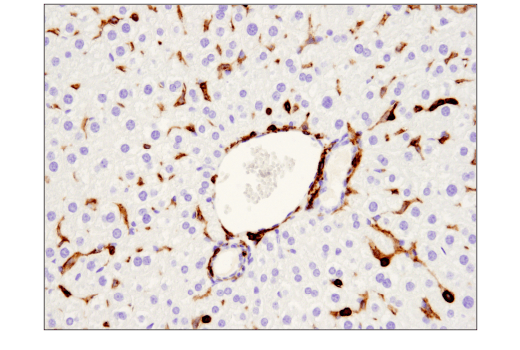
最常用于免疫组织化学的另一个二元策略涉及在同一切片中验证含有阳性细胞和阴性细胞的组织样本中的抗体。如图 9 和图 10所示,观察到的染色图案与靶标的已知表达特征一致(即,正确细胞阳性染色,阴性细胞无染色)。
虽然二元模型提供了宝贵的价值,它们并非总是容易获得,也不易于快速达到验证抗体试剂的目的。为支持二进制测试数据,或作为评估抗体性能的替代方法,应采用其他验证方法。