针对磷酸化蛋白的抗体通常会与相关蛋白发生交叉反应,导致出现交叉反应性条带或假阳性信号。我们在许多相关研究应用中对两种 XP® 单克隆抗体 [Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP® Rabbit mAb #4370 和 Phospho-Met (Tyr1234/1235) (D26) XP® Rabbit mAb #3077] 和竞争产品进行了比较。
| CST #4370 | 竞争公司 1 | 竞争公司 2 | |
|---|---|---|---|
| 蛋白质印迹法稀释度 | 1:2000 | 1:100 | 1:100 |
| 检测浓度 (µg/mL) | 0.222 | 1 | 10 |
| 建议的应用 | W, IP, IHC-P, IF-IC, F | W, IP, IF | W, IHC-P, IHC-F |
| 物种交叉反应性 | H, M, R, Hm, Mk, Mi, Dm, Z, B, Dg, Pg, Sc, (Ce) | H, M, R, Dg | H, M, R, (C, X, Z) |
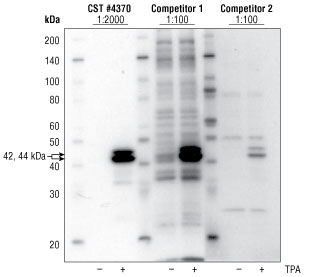
结果图 1. Jurkat 细胞不作处理或用佛波酯 TPA #4174(200 nM,10 分钟)处理,随后用血清饥饿过夜,以诱导 p44/42 蛋白的磷酸化。#4370 按建议的稀释度使用,并且两个竞争公司的抗体均按制造商建议的稀释度范围内的最高浓度使用。经 TPA 处理后,所有抗体都显示了预期的信号诱导作用。两个竞争公司的抗体都显示了较大的背景染色,竞争公司 1 的抗体显示了许多交叉反应性条带,且竞争公司 2 的抗体也显示了整体染色稍弱。
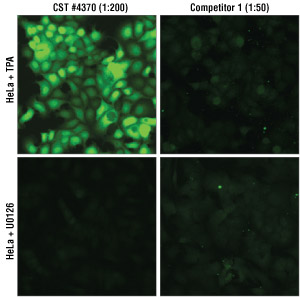
结果图 2. HeLa 细胞用 MEK 1/2 抑制剂 U0126 #9903(10 µM,2 小时)或 TPA #4174(200 nM,30 分钟)处理,随后用血清饥饿过夜。#4370 按建议的最佳 IF-IC稀释度 (1:200) 使用,竞争公司 1 的抗体根据制造商建议按 1:50-1:500 的稀释范围使用(数据未显示)。使用测定的最佳浓度时,竞争公司的抗体在经 U0126 处理的细胞中显示出更多的背景染色(均为胞核和细胞浆染色),而在刺激的细胞中,仅显示少量弥漫性细胞浆染色。经 TPA 处理后,使用 #4370 时观察到预期的倍性诱导,但在经竞争公司产品染色的细胞中仅观察到极少诱导作用,并且抗体整体看起来“更暗淡”。
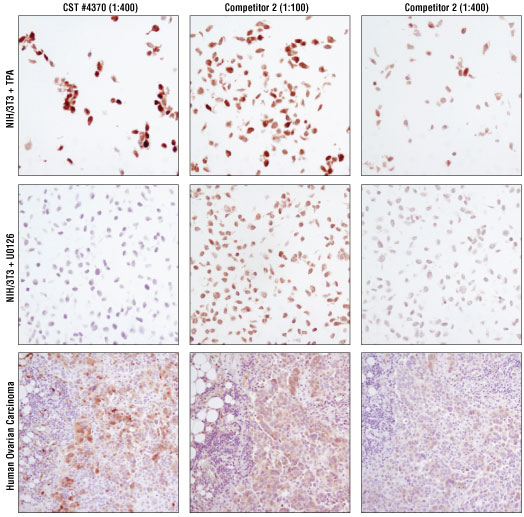
结果图 3. 比较#4370 与按两种浓度检测的经 IHC 验证的竞争公司的抗体。对 #8103 [经 TPA #4174(上图)或 U0126 #9903(中图)处理的石蜡包埋的 NIH/3T3 细胞沉淀物] 和石蜡包埋的人卵巢癌细胞(下图)进行 IHC 分析。使用 1:400 的最佳建议稀释度时,#4370 在细胞沉淀物系统中显示适量染色。竞争公司 2 的抗体需要稀释度为 1:400,以去除阴性对照、经 U0126 处理细胞中的染色。但在这种稀释度下,阳性对照、经 TPA 处理的细胞中的信号会显著减弱。稀释比例为 1:100(建议的最低稀释度)时,竞争公司 2 的抗体染色在人卵巢癌组织中较少,并且如果是在经 U0126 处理的细胞中观察到染色,则不能考虑为具有特异性。在对竞争公司 2 抗体使用稀释度为 1:400 时,几乎不可见组织染色。相比之下,#4370 表明在人卵巢癌细胞中的特异性染色增强。
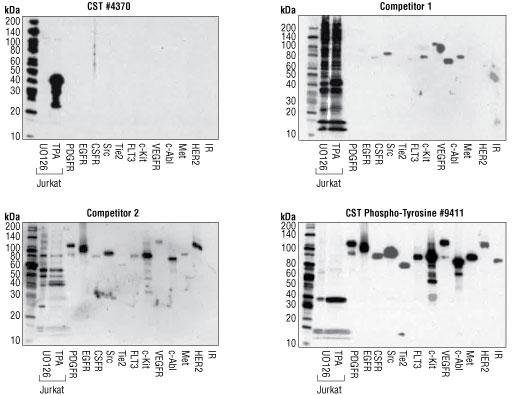
结果图 4. 使用一组重组酪氨酸-磷酸化蛋白进行的蛋白质印迹分析显示,#4370 无法检测到交叉反应性,并且使用检测的两个竞争公司的抗体时,与其他酪氨酸磷酸化蛋白具有显著交叉反应性。Phospho-Tyrosine Mouse mAb (P-Tyr-100) #9411 可用来证明蛋白上样量,并验证标记重组蛋白的分子量。这些结果表明 #4370 具有出色特异性。
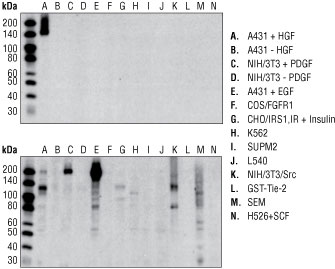
结果图 5. 使用 #3077 对经 HGF 刺激的 A431 细胞进行蛋白质印迹实验,观察到一条 145 kDa 的条带,但在未经刺激的 A431 细胞中则未观察到(上图)。经生长因子(可激活其他 RTK 或使其他 RTK 或细胞浆酪氨酸激酶过表达)处理的提取物均为阴性。通过比较,发现竞争公司的磷酸化 Met 抗体可识别多种非特异性条带(下图)。两种膜于相同曝光时间(10 秒)在相同膜上显色。
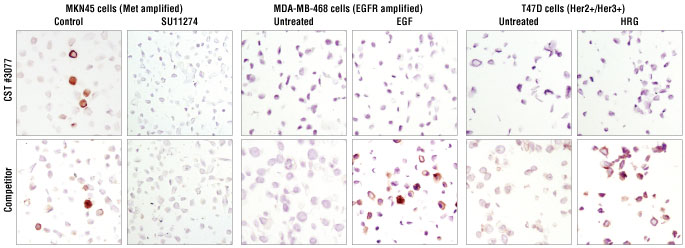
结果图 6. 对经 Met 抑制剂 SU11274 处理的石蜡包埋的 MKN45 细胞所进行的免疫组织化学分析表明,与对照相比,使用 #3077 和竞争公司的抗体时均没有出现染色。用 EGF 和 HRG 分别处理 MDA-MB-468 和 T47D 乳腺癌细胞系后表明,与对照相比,使用 #3077 时没有出现染色增强。相比之下,使用两种处理时,竞争公司的抗体检测到非特异性染色,表明与其他 RTK 具有交叉反应性。