精心策划的实验,具有适当的控制、处理和条件,通常是获得改进结果的第一步。要了解有关规划蛋白质印迹实验的更多信息,请查看我们的蛋白质印迹实验指南。
选择疑难排解的主题:
| 问题 | 可能的原因 | 建议 |
|---|---|---|
|
信号弱或无信号 |
重复使用预稀释的抗体 |
不建议重复使用稀释的抗体,因为稀释后的抗体稳定性较差,并且存放太久的稀释缓冲液容易产生微生物或真菌污染。我们建议始终使用新鲜稀释的抗体,以获得最适结果。 |
|
组织或细胞系中的蛋白表达水平低 |
我们建议使用 BioGPS 或 Human Protein Atlas 等表达谱分析工具以及科学文献,来查找细胞或动物组织是否预期能够充分表达目的靶蛋白。我们始终建议设置已知的阳性对照,以判断实验结果。如需了解我们许多抗体的推荐对照信息,请参阅我们靶标的阳性对照处理表。 对于全细胞提取物,每个泳道建议上样至少 20-30 ug 的蛋白,以便检测全组织提取物中的靶标总量/未修饰靶标量。然而,通常需要将总蛋白上样量增加到每个泳道至少 100 ug,以检测全组织提取物中的修饰靶标(如磷酸化和剪切靶标)。当组织中只有一小部分细胞含有翻译后修饰靶标时,全组织提取物可能需要上样更多蛋白。在细胞提取物中加入蛋白酶和磷酸酶抑制剂,对于避免蛋白降解和维持蛋白得率至关重要。我们建议往裂解缓冲液中加入亮抑酶肽(最终浓度为 1.0ug/mL)和 PMSF (#8553) 作为蛋白酶抑制剂。还可以使用 Protease Inhibitor Cocktail (100X) (#5871) 或 Protease/Phosphatase Inhibitor Cocktail (100X) (#5872)。 |
|
|
磷酸化或修饰蛋白的水平低 |
在未处理的细胞系或组织中,许多翻译后修饰蛋白的基底表达水平较低。我们建议使用 PhosphoSitePlus 查找与您特定修饰位点有关的使用低通量方法的文献,或使用我们靶标阳性对照处理表查找处理方法以及可作为阳性对照的细胞系或组织。 在细胞提取物中加入蛋白酶和磷酸酶抑制剂,对于避免蛋白降解和维持蛋白得率至关重要。应将焦磷酸钠(最终浓度为 2.5 mM)和 β-甘油磷酸盐(最终浓度为 1.0 mM)作为丝氨酸/苏氨酸磷酸酶抑制剂加入裂解缓冲液中。应加入正钒酸钠(最终浓度为 2.5 mM)以抑制酪氨酸磷酸酶。还可以使用 Protease Inhibitor Cocktail (100X) (#5871) 或 Protease/Phosphatase Inhibitor Cocktail (100X) (#5872)。 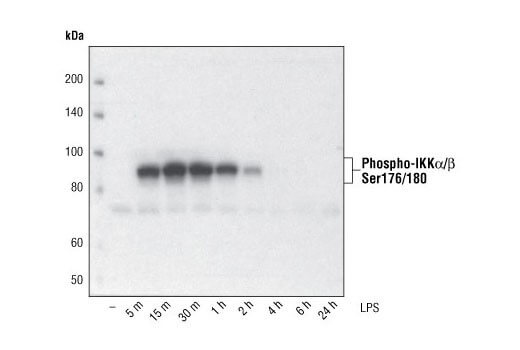
|
|
|
分泌蛋白 |
某些靶蛋白会被细胞分泌至胞外,因此在全细胞提取物中无法有效检测到。分泌型靶标可使用丙酮进行沉淀或浓缩后的细胞培养基检测。在某些情况下,可使用 Brefeldin A (#9972) 等化学调节物抑制细胞分泌目的蛋白。 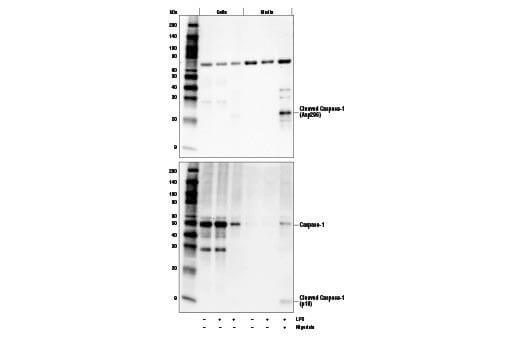
|
|
|
抗体灵敏度和反应性 |
请查看抗体网页的“灵敏度/特异性”部分。敏感性仅为转染性或重组蛋白的抗体不足以检测靶标的内源性水平。内源性灵敏度抗体适用于所有样品类型(内源性、转染或重组蛋白)。另外,可能需要增加或减少抗体用量,以获得最适信号,具体取决于样品中的靶蛋白丰度。我们建议以产品网页和说明书上显示的稀释比作为优化的起点。 另一个需要考虑的因素是抗体的物种反应性。CST 已对产品网页“反应性”部分列出的物种进行了内部验证。如果您的目的物种未列出,请联系我们的技术支持团队,他们将非常乐于帮助您确定抗体与您模型物种的蛋白序列的预期反应性。 |
|
|
裂解不完全 |
无论使用哪种裂解缓冲液,CST 都建议进行超声处理,以确保充分裂解和最大/一致的蛋白回收率。超声处理对于确保膜结合和细胞器(如胞核和线粒体)靶标的高效蛋白提取是必不可少的,并且还能剪切会干扰 SDS-PAGE 凝胶电泳的胞核 DNA。建议使用探头超声波仪进行最适的样品制备。对于 1 mL 样品,在冰上用 Microtip 探头超声波仪以 15W(或 50% 功率)进行 3x 10 秒破碎。但较好的其他方案是重复通过细(如 24 号)针反复抽吸或用玻璃珠涡旋。超声处理后,对样品进行离心,对不溶性细胞碎片进行沉淀,并用上清液用于进行蛋白印迹实验。 |
|
|
缓冲液选择不佳 |
要使抗体获得最适结果,请参阅产品网页上的蛋白免疫印迹实验步骤,了解推荐的一抗稀释缓冲液(即 BSA 或牛奶)。如果没有用推荐的稀释缓冲液孵育抗体,可能会严重损害结果的特异性/灵敏度。例如,脱脂奶粉对于我们许多一抗孵育而言,条件过于严苛。一般来说,CST 建议使用 1X TBS/0.1% Tween-20/5% 脱脂奶粉进行封闭和二抗孵育,以尽量减少非特异性背景。使用其他封闭剂,如明胶、血清、无蛋白封闭剂、酪蛋白、或混合封闭剂,可能降低靶标信号强度。 许多研究者对使用脱脂奶粉作为稀释缓冲液来检测磷酸化蛋白表示担心。具体来说,人们认为牛奶中的酪蛋白会导致高背景。在 CST,我们在使用脱脂奶粉检测磷酸化蛋白时未发现任何问题。所有 CST 抗体在上市前均用 5% 脱脂奶粉和 5% BSA 进行了检测,并且选择了最适稀释缓冲液作为推荐缓冲液。 封闭、抗体孵育(一抗和二抗)和洗涤缓冲液均应使用 1X TBS/0.1% Tween-20 配置。较高或较低百分比的 Tween-20 会影响结果的敏感度/特异性。使用 PBS 而非 TBS 可能会降低我们某些抗体的信号强度。 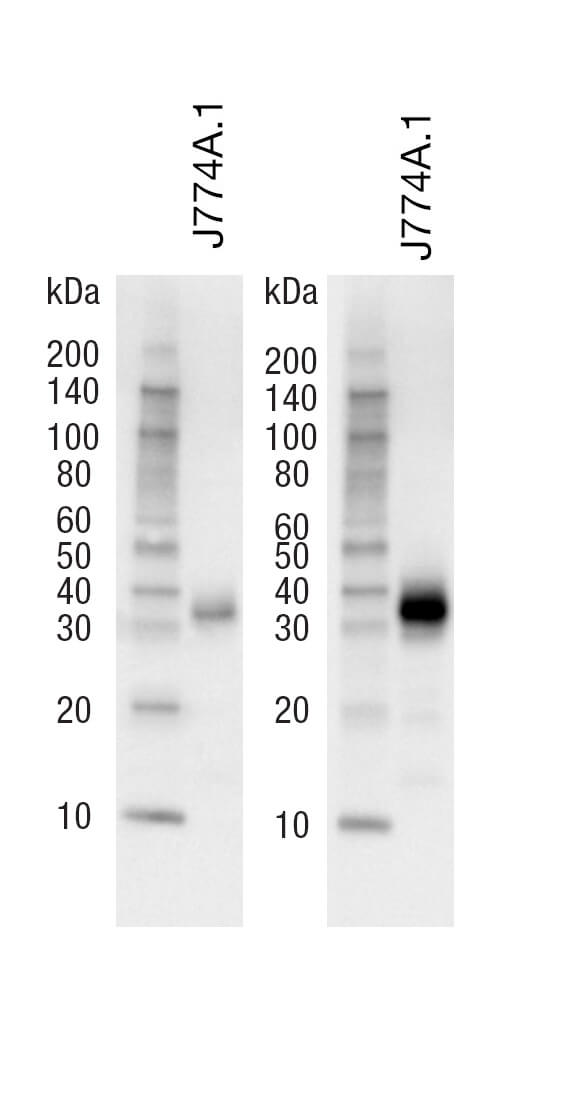
|
|
|
转移条件不佳 |
我们通常建议在 4°C 下用 25mM Tris、192mM 甘氨酸和 20% 甲醇以 70V (200-250mA) 进行湿转移,持续 2 小时。但对于高分子量蛋白,我们建议将转移缓冲液中的甲醇含量降至 5-10%,并将 70V 下的转移时间延长至 3-4 小时 (200-250mA)。对于半干式转移,请参阅制造商的建议。 对于低分子量蛋白,务必要避免过度转移或“穿过”(小分子量靶标)。我们建议缩短转移时间,并使用孔径为 0.2 um 的硝酸纤维素转移膜,以最大程度减少低分子量(即小于 25-30 kDa)蛋白的流失。 |
|
|
多个条带或非特异性结合 |
同工型反应性 |
某些细胞系和组织模型可以包含多种蛋白同工型或剪接变体,它们可以迁移至不同的分子量。请参阅抗体网页上的“特异性/灵敏度”部分,确定是否能预测检测或确认检测到多种同工型。还可以在 UniProt 上查阅目的蛋白,看看是否列出了多个同工型序列。 |
|
翻译后修饰 |
翻译后修饰 (PTM) 会导致部分靶蛋白的电泳速率与未修饰蛋白不同。因此,诱导或抑制某些翻译后修饰的处理条件会导致在蛋白印迹中观察到多个条带。糖基化、SUMO 化、泛素化和磷酸化便是修饰的例子,这些修饰可能导致蛋白印迹上出现多个条带,具体取决于使用的样品和处理方法。如果您正在查找更多靶蛋白相关的 PTM 信息,请参阅 PhosphoSitePlus。 |
|
|
组织样品 |
组织样品是非均质的(即由不同细胞类型组成),所以在其它样本(如细胞系)中检测不到非特异性条带的抗体,在组织样本中检测到非特异性条带的概率相对较高。此外,某些组织模型可能含有多种蛋白同工型或剪接变体,它们可以迁移至不同的分子量。 |
|
|
裂解物降解 |
样品中的蛋白酶和磷酸酶会快速降解蛋白。在裂解物中添加蛋白酶和磷酸酶抑制剂,有助于减缓或防止蛋白降解。我们建议往裂解缓冲液中加入亮抑酶肽(最终浓度为 1.0ug/mL)和 PMSF (#8553) 作为蛋白酶抑制剂。还可以使用 Protease Inhibitor Cocktail (100X) (#5871) 或 Protease/Phosphatase Inhibitor Cocktail (100X) (#5872)。 裂解物的长时间存放还可导致蛋白降解物增加,而蛋白降解物会通过抗体检测到。确保使用新鲜样品,以最大程度减少蛋白降解。在同一瓶样品中,某些蛋白的稳定性不如其他蛋白,因此,尽管一个样品可能可检测出某个靶蛋白,但同一样品中可能有不同的蛋白已有降解。 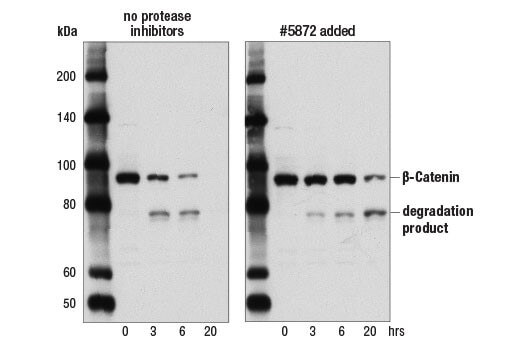
|
|
|
高蛋白浓度 |
如果使用高灵敏度抗体,膜上过量的蛋白会导致出现多个条带和高背景,且整个泳道中的信号强度过高,而这些是蛋白量较少时不会存在的。尝试上样更少的蛋白,以观察更清晰的信号。 |
|
|
曝光时间长 |
如果蛋白上样量太少,这会导致难以检测到目的蛋白,尤其是在样本类型中丰度较低的情况下。这反过来会导致需要延长曝光时间,以检测印迹上的靶蛋白。同时使用常见的 ECL 试剂时,CST 抗体经配制可在两分钟的曝光时间内产生信号。如果在该时间段内未观察到信号,则可能需要更高的蛋白浓度。 |
|
|
一抗稀释缓冲液不佳 |
一抗稀释缓冲液会影响膜背景。例如,与 BSA 相比,缓冲液(如脱脂奶粉)在降低印迹上的非特异性条带和总背景方面能起到更好的作用。但牛奶对于某些抗体而言可能过于严苛,会导致靶标信号减弱。请务必参考 CST 产品网页上推荐的蛋白免疫印迹实验步骤,选择合适的一抗稀释缓冲液(即 BSA 或脱脂奶粉)。一般来说,CST 建议使用 1X TBS/0.1% Tween-20/5% 脱脂奶粉进行封闭和二抗孵育,以尽量减少非特异性背景。 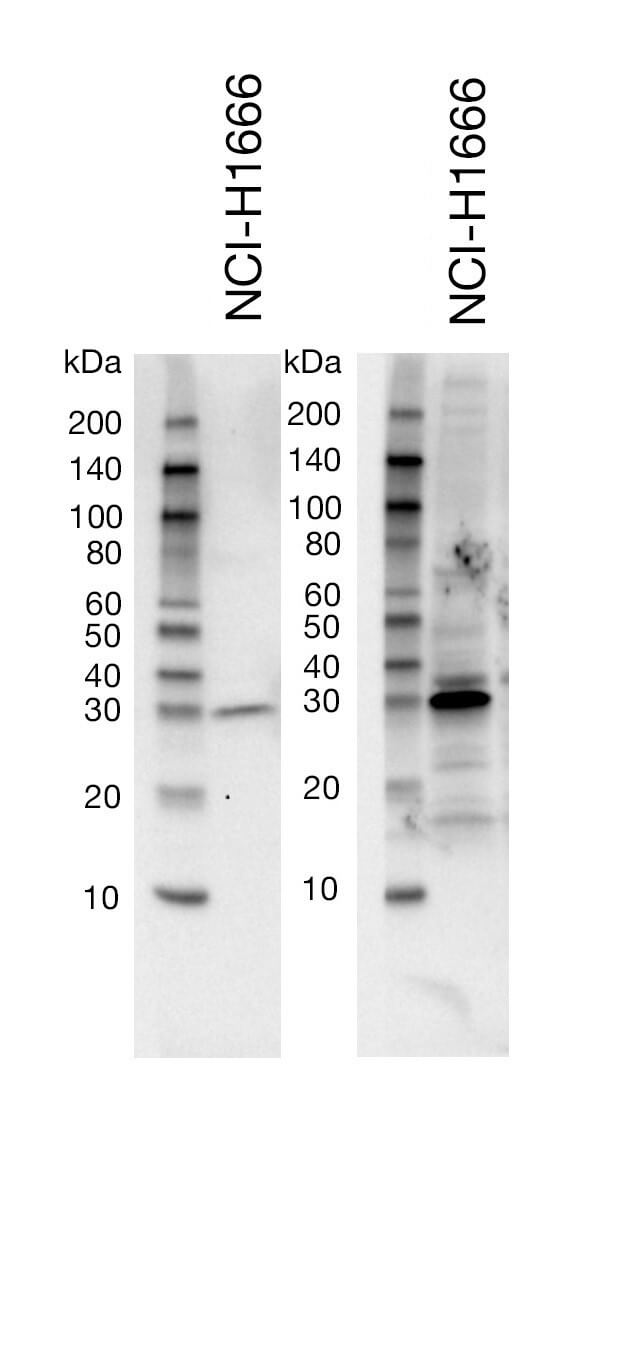
|
|
|
拖尾效应 |
糖基化蛋白 |
不同的糖基化通常导致在分子量高于预测的分子量处产生条带拖尾效应。靶蛋白中糖基化的潜在位点可见于 PhosphoSitePlus。将您的样本使用 PNGase F处理,一种在糖蛋白上剪切N-聚糖的酶,也可确认分子量变化是否因糖基化产生。 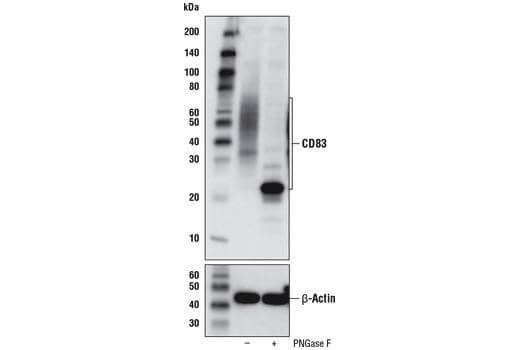
|
|
裂解物降解 |
样品中的蛋白酶和磷酸酶会快速降解蛋白。在裂解物中添加蛋白酶和磷酸酶抑制剂,有助于减缓或防止蛋白降解。我们建议往裂解缓冲液中加入亮抑酶肽(最终浓度为 1.0ug/mL)和 PMSF (#8553) 作为蛋白酶抑制剂。还可以使用 Protease Inhibitor Cocktail (100X) (#5871) 或 Protease/Phosphatase Inhibitor Cocktail (100X) (#5872)。 裂解物的长时间存放还可导致蛋白降解物增加,而蛋白降解物会通过抗体检测到,在分子量低于预期的靶标分子量时出现拖尾效应。确保使用新鲜样品,以最大程度减少蛋白降解。如果需要长期储存,我们建议将裂解物储存在 -80°C,以减少降解。在同一瓶样品中,某些蛋白的稳定性不如其他蛋白,因此,尽管一个样品可能可检测出某个靶蛋白,但同一样品中可能有不同的蛋白已有降解。 |
|
|
裂解不完全 |
无论使用哪种裂解缓冲液,CST 都建议进行超声处理,以确保充分裂解和最大/一致的蛋白回收率。超声处理对于确保膜结合和细胞器(如胞核和线粒体)靶标的高效蛋白提取是必不可少的,并且还能剪切会干扰 SDS-PAGE 凝胶电泳的胞核 DNA。建议使用探头超声波仪进行最适的样品制备。对于 1 mL 样品,在冰上用 Microtip 探头超声波仪以 15W(或 50% 功率)进行 3x 10 秒破碎。但较好的其他方案是重复通过细(如 24 号)针反复抽吸或用玻璃珠涡旋。超声处理后,对样品进行离心,对不溶性细胞碎片进行沉淀,并用上清液用于进行蛋白印迹实验。 |
|
|
深色或黑色印迹 |
高浓度二抗 |
使用太多二抗(即辣根过氧化物酶)和更灵敏的检测试剂 [如我们的 SignalFire™ Elite ECL Reagent (#12757)] 时,会出现伴有或不伴有反白“鬼影”条带的黑色印迹。这最好通过增加 HRP 偶联二抗的稀释度(例如,从 1:2000 到 1:10,000)解决。 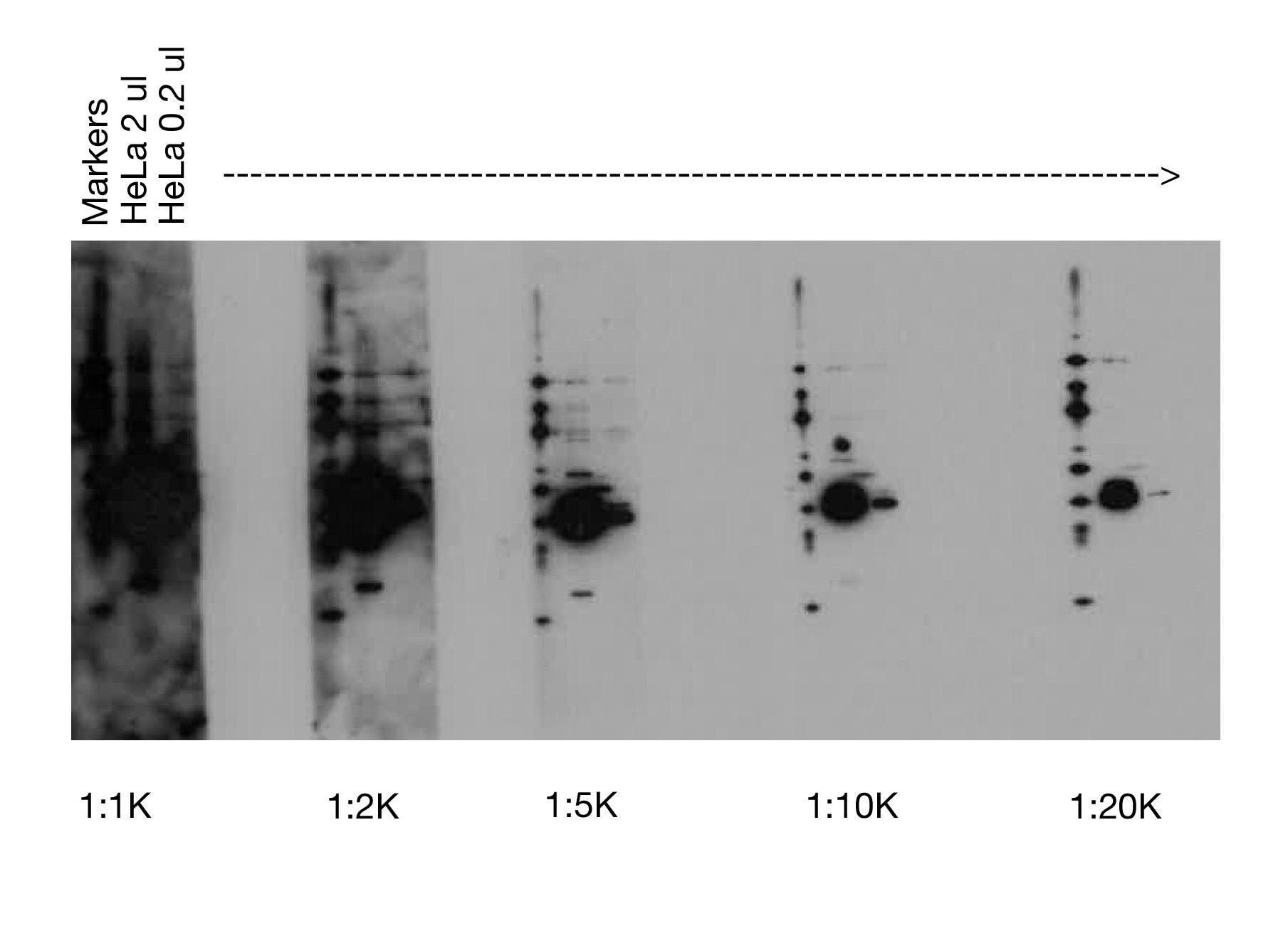
|
|
洗涤不充分 |
洗涤时间缩短可能致使过多抗体残留在膜上,导致化学发光曝光后形成暗印迹。CST 建议在用一抗和二抗孵育后,用 1X TBS/0.1% Tween-20 常温洗涤三次,每次五分钟,以获得最适的结果。 |
|
|
缓冲液选择不佳 |
使用封闭缓冲液以及是否加入其他去垢剂均会影响膜背景。例如,与 BSA 相比,缓冲液(如脱脂奶粉)在降低印迹上的非特异性条带和总背景方面能起到更好的作用。但牛奶对于某些抗体而言可能过于严苛,会导致靶标信号减弱。请务必参考产品网页上推荐的蛋白免疫印迹实验步骤,为一抗孵育选择适当的稀释缓冲液(即 BSA 或脱脂奶粉)。一般而言,CST 建议使用 1X TBS/0.1% Tween-20/5% 脱脂奶粉进行封闭和二抗孵育,以最大程度减少非特异性背景。 |
|
|
膜复水 |
为了获得最适性能,我们建议直接将硝酸纤维素膜放在转移缓冲液中复水。但使用 PVDF 时,在将膜移至转移缓冲液之前,应将膜放在甲醇中短暂复水。 |
|
|
散斑或斑点样印迹 |
转移海绵污染 |
长时间未经过适当消毒的转移海绵可能含有细菌污染物。要排除这个因素,请使用新的转移海绵。 |
|
缓冲液污染 |
存放天数较多的缓冲液可能有更多细菌和真菌污染物,这些污染物会导致膜上出现斑点。我们建议始终使用新鲜配制的缓冲液,以获得最适效果。 |