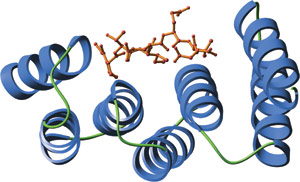
结合 Hsp70 羧基末端肽的人 Hop 的氨基末端 TPR 结构域(红色)。
三十四肽重复序列 (TPR) 基序最初在酵母中发现,是细胞周期蛋白中的一种蛋白间相互作用模块。自此,它还在从细菌到人的各种生物中被发现。TPR 基序是一种约含 34 个氨基酸的退化序列,松散地位于共有残基 -W-LG-Y-A-F-A-P- 周围。该序列以串联排列的方式存在,并且存在于 800 种不同蛋白中。含 TPR 基序的蛋白可作为不同多蛋白复合体组装的支架,这些复合体包括后期促进复合体、过氧化物酶体输入受体和 NADPH 氧化酶复合体。
TPR 基序在很大程度上会显示出序列多样性。但结构比较表明具有一个高度保守的三维结构。单独的 TPR 结构域包含两个由一个转角分开的反向平行 α 螺旋。多个 TPR 结构域按规则角度排列,并形成一个右侧超级螺旋。这会形成一个凹槽,其中大部分表面区域可用来结合配体。
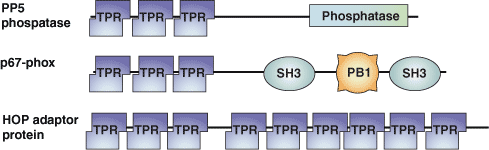
| TPR 结构域蛋白 | 结合伴侣 | 肽配体 |
| PEX5 | PTS-1 靶标信号 | S-K-L-COOH |
| Hop | Hsp70 - 羧基末端七肽 Hsp90 - 羧基末端五肽 | E-E-V-D-COOH E-E-V-D-COOH |
| p67phox | GTP-Rac | 表面结合 |