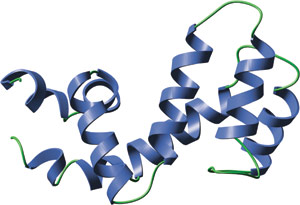
RGS-4 的 RGS 结构域。
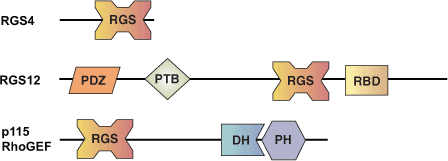
RGS(G 蛋白信号转导调节分子)结构域在 20 多种人蛋白中被发现,长约 120 个氨基酸。RGS 结构域会使异三聚体 G 蛋白 α 亚基 GTP 结合口袋的转换中间物变得稳定,从而起到变构作用。这会增强 α 亚基的固有 GTP 酶活性。RGS 结构域的发现解决了长期悬而未决的关联:许多异三聚 G 蛋白相对较慢的内在水解率、需要 G 蛋白作用的信号转导过程的实际循环时间。异三聚体 G 蛋白传递七次跨膜受体的信号,这些受体可被许多重要的激动剂激活,包括激素、神经递质、光和香味剂。编码 RGS 结构域的蛋白还可调控每种激动剂的传递时间,从而调节这些信号转导活动。
RGS 结构域包括形成一个右侧反平行四螺旋束 (α4-7) 的 9 个 α 螺旋以及一个包含结构域氨基末端和羧基末端的末端束 (α1-3, α8-9)。RGS4 和 Gai 之间的相互作用表面由 α3-4 之间的环、α5-6 之间的环以及 α7 末端和 α8 起始端形成。所有 RGS 结构域都有一个高度相似的三级结构,甚至是具有低氨基酸同源性的成员。有趣的是,RGS 结构域的结构与单体 G 蛋白(如 p120 RhoGAP) 的 GAP 结构域大不相同。
| RGS 结构域蛋白 | 结合伴侣 |
| RGS-4 | GΑi, GΑq |
| p115 RhoGEF | GΑ12, GΑ13 |
| RGS-2 | GΑq |
| GAIP | GΑi, GΑq |