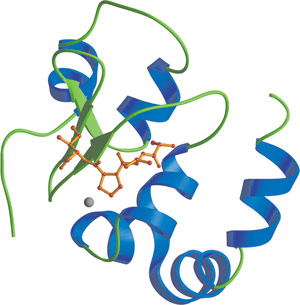
显示锌原子且结合 Smac 氨基末端残基的 XIAP 的第三个 BIR 结构域(红色)。
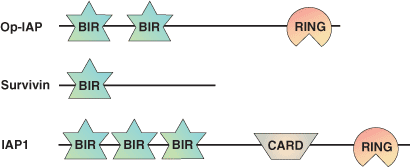
杆状病毒 IAP 重复序列 (BIR) 结构域是一个约含 70 个氨基酸的锌结合结构域,最初通过属于 凋亡抑制因子 (IAP) 家族的蛋白之间的序列同源性检测到。对于每种蛋白,BIR 结构域存在于 1-3 个串联拷贝中,它在真核生物的 80 多种不同蛋白中检测到。有关 BIR 结构域的多数已知信息来源于其在 IAP 蛋白中的作用。IAP 会结合并抑制 caspase , caspase 是一类参与细胞内传递凋亡信号的半胱氨酸蛋白酶。BIR 结构域是 IAP 蛋白与许多促凋亡因子相互作用所必需的,这些因子包括无脊椎动物死亡诱导物(即果蝇 Reaper、Grim、HID 和 Doom)及脊椎动物和脊椎动物 caspase 蛋白酶。在抑制 caspase-9 的过程中,XIAP 的第三个 BIR 结构域会与在 caspase-9 p12 小亚基的连接肽上被发现的氨基末端 ATPF/AVPY 基序相互作用,这种基序在 procaspase-9 溶蛋白性裂解后会暴露出来。Smac/Diablo 蛋白会调节这种相互作用,它提供一种高亲和力 BIR3 相互作用肽,以阻止 XIAP BIR3 结合,并随后将 XIAP 与 caspase-9 分离。XIAP 的第二个 BIR 结构域可作为 caspase 结合的调节元件,从而发挥抗凋亡作用,而氨基末端连接物则会与 caspase-3 和 -7 相互作用,并阻断其底物凹槽。这种连接肽位于 caspase 激活位点,方向与底物结合相反。第二个 BIR 结构域的缺失会破坏 XIAP 的抗凋亡功能,因为这个 BIR 结构域的删除会阻止蛋白出现影响 caspase 结合的构象。最后,BIR 结构域似乎还能介导亲同种抗原的相互作用。
| BIR 结构域蛋白 | 结合伴侣 |
| Survivin | 通过同型相互作用结合的生存素 |
| Op | HID, Grim, Reaper |
| D-AIP1 | HID, Grim |
| D-AIP2 | Reaper |