要进行胞内流式细胞术,需进行细胞固定和通透,才能让抗体渗透并随后结合靶标,而不会破坏细胞形态。
下面,我们讨论多种关键因素,以确保成功的实验设计,尤其是在研究翻译后修饰 (PTM) 时。
对 PTM(如磷酸化)进行流式细胞分析,需要对通路激活临界窗口期内的细胞进行固定。使用 4% 甲醛(不含甲醇)固定可最佳交联胞内蛋白和所有相关修饰。此外,让负责去除修饰的酶活性(如磷酸酶)失活。如果交联范围包括靶标表位,则对于某些靶标来说,可能需要更低浓度的甲醛。
通过逐滴添加冰冷的 90% 甲醇进行通透处理可保持细胞结构完整性,同时让抗体高效渗透,但不会让之前经乙醛固定的 PTM 表位变性 (1)。
体外刺激全血会干扰血基质中的外周血细胞,导致模型在通路信号转导和其他细胞过程方面更具生理相关性。用 4% 甲醛固定会让蛋白质相互作用变得稳定,并且随后用 0.1% Triton X-100 处理会裂解红细胞 (RBC) (1)。用 50% 甲醇进行通透可保留表面标记物完整性,从而同时分析表面和胞内靶标

Btk (D3H5) Rabbit mAb #8547: 人全血细胞按照 CST 的流式细胞术备选实验步骤中的说明进行固定和通透处理,并使用 #8547 染色。前向散射 (FSC) 和侧向散射 (SSC) 用于对淋巴细胞设门 (A)。样品用 CD3-PE 和 CD19-APC 共染色,以区分 T 和 B 细胞亚群 (B)。B(红色)和 T(蓝色)细胞群设门用于表示 Btk 平均荧光强度的柱状图 (C)。
设计实验时,解释细胞系统的复杂性始终很重要。在某些情况下,基底修饰水平可能会很高,因此,刺激目的通路不会提供任何其他可检测的信号,这可以解释为是一个假阴性结果。对于磷酸化蛋白,这是一个常见的现象。要解决这个问题,固定和通透的样品可用磷酸酶处理,以去除蛋白的磷酸基,随后检测指示高基底磷酸化水平的信号是否减弱。血清饥饿或激酶抑制剂处理会降低活细胞中的内源性磷酸化水平。相反,由于存在内源性磷酸酶活性,可能会难以捕捉瞬变的磷酸化活动,在这种情况下,用磷酸酶抑制剂处理有助于维持磷酸化信号。
A | B | C |
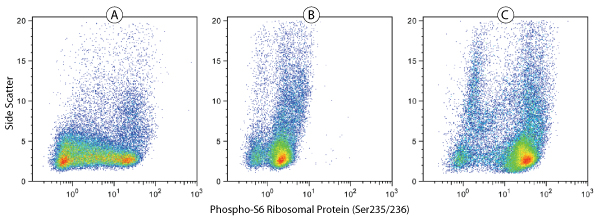
Phospho-S6 Ribosomal Protein (Ser235/236)(D57.2.2E) XP® Rabbit mAb (Alexa Fluor®488 Conjugate) #4803: 人全血细胞按照 CST 流式细胞术备选实验步骤进行固定和通透,随后不作处理 (A)、或用 λ 磷酸酶 (B) 或 TPA #4174 (C) 处理,之后用 #4803 染色。
对照可让研究人员确定存疑的测定法是否能正常发挥作用。如果要考虑很多因素,精心的对照设计对解释流式细胞实验的结果尤为重要。考虑到这一点,我们建议在您的工作流程中加入以下类型的对照:
下表列出了有关以上三类的每类的相应对照。
| 对照 | 为何需要? |
|---|---|
| 未染色细胞 |
|
| 完全染色的细胞 |
|
| 染有单独荧光标记物的细胞样本/珠子 |
|
| 同型对照 |
|
| 荧光扣除对照 (Fluorescence Minus One, FMO) 染色 |
|
| 未刺激或未经处理的样品 |
|
| 阳性细胞(经刺激) |
|
| 染有死活细胞鉴定染料(如碘化丙啶)的细胞 |
|