流式细胞术是一种基于荧光的检测,从悬浮于溶液中的单个细胞就能同时测定多种特性,例如细胞群计数和蛋白丰度。它是一种强大的工具,可实现细胞特性的快速、定量和准确测定,并且提供针对细胞群异质性的卓越解读。
这是使用引导单个细胞流通过光源并测定各种波长中所产生的光能散射和发射的仪器实现的。研究人员使用具有不同激发和发射特性的荧光分子,以便能够合并、检测和区分它们,从而在单个细胞中获得多个读数。这些荧光分子可以附接到靶向特定蛋白或蛋白修饰的抗体上,或者它们可作为染料直接结合细胞组分。
流式细胞术是一种高度通用的应用,可提供简单的单靶标读数或复杂的亚群表型分析以及细胞信号转导分析。由于流式细胞术依赖于细胞处于悬浮状态,以便它们能够通过照明源流动,因此它与那些天然以单细胞悬浮液形式存在的生物样品(如白细胞)高度兼容。然而,黏附细胞甚至是组织样品都可能被流式细胞术当作单细胞悬浮液进行解离和分析。
流式细胞术非常适合于需要在单个细胞水平上获得定量信息,从而获得细胞水平和/或细胞群水平的理解。正在分析的定量信息可提供有关给定类型细胞的数量、该细胞类型中存在的特定蛋白的数量或该蛋白的功能活性的见解,举几个示例。由于可同时收集多个读数,流式细胞术还能实现某细胞水平下各读数之间的相关性。
将此技术与蛋白印迹法等不可逆地将细胞群组合成单个读数的应用形成对比。流式细胞术允许研究人员提出复杂的问题,例如,在治疗作用下,三种免疫细胞类型中的两个关键信号转导通路的活性如何变化,并在几小时内通过标记和在流式细胞分析仪上运行单个样品来得到答案。对于相同的问题,使用蛋白印迹法则需要数天时间才能得到答案。
但并非所有生物学研究问题都能使用流式细胞术解决。组织中细胞的空间分布无法使用流式细胞术进行评估,因为需要在分析前将样品解离为单细胞悬浮液。对于该分析,优先使用免疫组织化学法或组织免疫荧光法。精细亚细胞分析更适合通过荧光和/或共聚焦显微镜进行的分析,但成像流式细胞分析仪在这方面取得迅速进展。基因突变或大规模 mRNA 分析更适合使用测序仪器进行。但是,当涉及快速细胞水平定量时,极少有测定法能够超越流式细胞术。
在细胞生物学中,流式细胞术的一种常见用途就是检测和定量样品中存在的细胞类型。由于不同的细胞类型在其表面上表达的蛋白不同,因此可实现细胞检测。抗体可特异性靶向这些蛋白,有效添加一个彩色标记,从而区分一种细胞类型与另一种细胞类型。
该过程称为免疫表型分析,使研究人员能够理解和监测某种异质细胞群中存在的细胞类型的数量和百分比。免疫表型分析有益于表征免疫系统的各种组分,因为这些细胞存在于血液的悬浮液中,并且差异表面蛋白的特征极其明确。
免疫表型分析通过抗体荧光标记来实现,这一过程称为偶联。当靶向不同蛋白的抗体与发不同颜色荧光的染料偶联时,即使流式细胞分析仪同时检测到它们,也可对其进行独立分析。同时添加多种抗体的过程称为多重分析。多重分析只能同时涉及两种抗体或可延伸至多组抗体。这些抗体组能够实现单个样品内多种免疫细胞类型的免疫表型分析,并且能够提供有关各种关键免疫细胞类型(例如 T 细胞、B 细胞和单核细胞)亚群的更深入理解。
流式细胞术是精选用于免疫表型分析的方法,因为它非常快,每秒能定量数千个细胞。实验设置只需不到 30 分钟的时间,并且在单次检测中检测多个读数的能力意味着可在不到一小时的时间内标记、运行和分析样品。将此技术与蛋白印迹法进行对比,在蛋白印迹法中,不同细胞群只能使用基于抗体的富集步骤进行分析,以选择性纯化细胞。相比之下,这会增加已经很漫长的检测的时间,并且不提供细胞水平分析,从而无法评估纯化细胞群中的异质性。
使用流式细胞术进行表型分析的另一个优势在于,该方法适合活细胞。因此,一些仪器能够在进行后续实验分析后,保留特定的细胞群。此功能通常仅限于被称为分选仪的仪器。
可实时使用正在通过流式细胞分析仪测定的特性,以在物理方面将细胞分选进不同的容器中。该过程需要一种称为细胞分选仪的特殊型流式细胞分析仪,且该过程称为荧光激活细胞分选法 (FACS)。特定荧光读数或读数集将定义为将该细胞放在一个特定容器中的临界值。这些读数可能来自细胞内的荧光蛋白,或者来自标记细胞的荧光抗体。FACS 中常使用暴露在细胞表面上的免疫表型标记物,因为这些标记物可以在细胞存活时用抗体进行标记。研究人员通常倾向于对活细胞进行分选,以便可使用经隔离的细胞群进行后续实验。
大多数关键生物过程都发生在细胞内。因此,虽然细胞表面上的蛋白可以用来检测细胞类型,但胞内蛋白的丰度和活性可驱动几乎所有的细胞过程。对胞内蛋白进行定量的能力可提供对细胞生物学的机制见解,并能发现疾病状态下的异常活动。
各蛋白的数量并不是细胞能够进行调节和进行生物活动的唯一方法。当细胞需要传递来自细胞表面受体的信号时或在细胞本身内各种条件的刺激下,翻译后修饰 (PTM) 通常是永久性保存该信号的一种关键方法。PTM 在定义蛋白的基因序列中未编码,而是在蛋白翻译后发生的改变。PTM 通常包括通过添加一个小分子(例如磷酸盐、乙酰基或甲基)来修饰蛋白内的单个氨基酸。PTM 还可包括添加一个小蛋白,例如泛素,或甚至是特定氨基酸序列蛋白的裂解物。
PTM 的目的通常是改变蛋白的活性、稳定性或功能,并且 PTM 中的原理就是磷酸化。磷酸化是细胞信号转导级联中研究最透彻的修饰。在磷酸化过程中,磷酸基被添加到蛋白内的氨基酸(通常是丝氨酸、苏氨酸或酪氨酸)上。氨基酸的磷酸化(有时与其他同时发生的磷酸化事件相结合)通常会改变蛋白的功能。酶磷酸化可以作为激发酶的开关,从而使其能够作用于其特异底物。该酶的功能可能是磷酸化一系列靶蛋白,从而启用或禁用其在细胞内的功能。磷酸化的优点在于,它使细胞能够预先合成关键功能蛋白,并使其随时准备执行某项活动,但在该活动需要执行之前,这些蛋白质通常保持失活状态。当信号提示细胞需要进行这项活动时,细胞无需耗费时间来制造执行该项活动所需的酶和蛋白,而只需使用快速磷酸化级联来打开“开启”开关。
抗体具有特异性,因此仅当某蛋白在特定氨基酸上被磷酸化时,它们才能够结合该蛋白。如果蛋白仅在某个氨基酸上被磷酸化后才能发挥功能,那么抗体结合的量就是细胞内该蛋白功能活性的直接读数。这些抗体称为磷酸化特异性抗体,它们为研究人员提供了强大的工具来了解某种实验处理可能对细胞生物活性产生的影响。它们能够发现特异性改变生物学过程的复合物,这通常是识别潜在治疗药物的第一步。
使用磷酸化特异性抗体通过流式细胞术可轻松检测磷酸化活动。实际上,凭借其灵敏度、定量和细胞水平数据采集,流式细胞术非常适合于细胞群中磷酸化的分析。这种方法称为“磷酸化流式细胞术”,以将其与活细胞流式细胞术区分开来。进行此区分的原因在于几乎所有的蛋白磷酸化都发生在细胞内这一事实,甚至对于跨过细胞膜的那些蛋白也是如此。因此,使用磷酸化特异性抗体必然需要这样一个实验步骤,从而让抗体能够跨过质膜并到达细胞内的靶标。此外,必须固定细胞以阻止其生物活性并防止磷酸化水平在实验过程中发生变化。虽然在活细胞流式细胞术中不使用固定和通透,但是这些步骤很简单,并且不需要改变流式细胞分析仪即可对一般性的磷酸化或蛋白水平进行胞内检测。
在流式细胞术中使用的仪器称为流式细胞分析仪,通常缩写为“细胞分析仪”。流式细胞分析仪由一个用于进行细胞处理的流体系统和一个包括数据采集信号检测器和处理器的光学系统组成。专为 FACS 设计的仪器还包含一个细胞分选组件,该组件可将细胞引导到不同的捕获容器中。
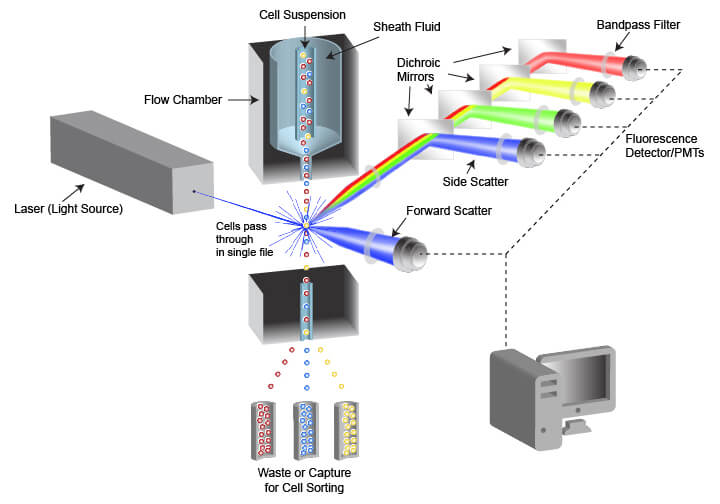
流体系统设计用于生成单细胞的均匀流,以确保当细胞被用于检测的光源照射时,能够进行适当分析。这通过使用加压管将细胞从样品管注入流室中来完成。从容器(通常是一根试管或一块多孔板)中抽取细胞样品,并将其注入流动液体(称为鞘液)层流中间的流室中。通过一个称为流体动力学聚焦的流程,鞘液可帮助缩窄细胞流,从而将细胞组织成一行大致单行的流线。一些细胞分析仪还使用声学聚焦来进一步对齐细胞。这可实现在细胞通过细胞分析仪中的光学系统时进行同等照亮和检测。
如果流体系统未经过充分校准,或者正在进行分析的样品中的细胞数量过多,那么在流经光学系统时,细胞会发生混杂和重叠现象,从而妨碍适当的单细胞分析。为了降低这种现象发生的可能性,许多流式细胞分析仪都能让用户更改流速或样品注入鞘液的速度。通过减缓注射速率,同时保持鞘液流量恒定,用户能够拉大密集样品中细胞的间距,并重新让细胞流通过检测器。
流式细胞分析仪的光学系统包括照明源、过滤器、透镜和收集光学器件。照明源常包括 1 个或多个激光束,且每个激光器发射的光波长不同。激光器会照亮流经细胞分析仪的细胞或其他物体,并收集散射激光和荧光发射。通过流式细胞分析仪定量两种光散射活动。前向散射源于平行于激光束的光的衍射,并且通常是从激光器前面通过的物体大小的一个因子。侧向散射源于与激光束成 90° 的光的折射,并且会根据物体的复杂性和光密度差异而发生改变。来自物体的荧光发射经常源于正在检测中使用的荧光染料,但也可能由细胞内的自发荧光所引起或源于物体本身(在使用荧光微珠的情况下)。散射光和荧光发射的强度或数量通过光电二极管 (PD) 或光电倍增管 (PMTS) 来定量,其可将光子转换成可以显示和分析的数值。有多种不同的检测器,因此可单独定量光散射和发射荧光的不同波长。检测器不区分各种光波长,而是通过放置在光路径中的过滤器来将光限制在所需波长范围内。
为了通过流式细胞术分析特定靶标,对细胞组分进行荧光标记。这可以通过使用单独的荧光分子(例如,细胞染料)或荧光团标记的抗体(直接偶联抗体或使用偶联二抗)来完成
.抗体是许多生物检测中的关键工具,在流式细胞术中也不例外。抗体具有特异性结合单个蛋白或蛋白修饰的能力,并且可作为一种方法来标记那些用于进行检测的靶标。通过标记目的靶标,研究人员可以评估各种细胞类型、疾病状态、治疗条件、发育阶段或其他生物模型中蛋白的丰度或活性。
与不同蛋白结合的抗体不会相互干扰,因此,可以使用多种抗体同时检测多个靶标。这称为多重分析。抗体数量的限制是独立于其他抗体测定每种抗体的能力。在流式细胞术中,这种差分测定使用称为荧光团的荧光分子来完成。成功的实验要求具有高度特异性和经验证的抗体以及可靠的荧光团。
荧光团的共同特性是能够发射与用于照亮染料的光相比波长更长的光。例如,如果使用蓝色激光器来照亮称为绿色荧光蛋白 (GFP) 的分子,那么蛋白会吸收蓝光并发射绿光。被吸收的光与被发射的光之间的波长差异称为斯托克斯位移。
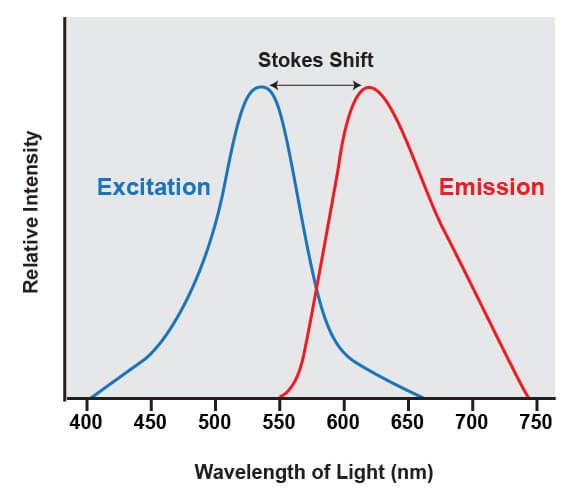
就是这种位移让人们能够准确定量来自荧光团的光,因为它能够过滤来自激发源的光的波长。激发源总是比从正在分析的荧光团中发射的荧光更亮些,并且如果这种光无法移除,那么它将会强烈影响检测器。
荧光染料吸收的光的范围称为“激发”光谱,而激发时其发出的荧光称为“发射”光谱。激发和发射光谱针对所有常见染料提供,并呈曲线显示各波长下吸收或发射的光量。
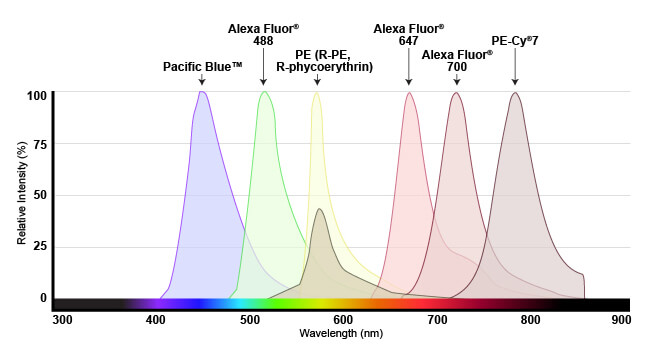
本概述使研究人员能够理解哪些染料将与其特定仪器一起作用。为了使染料有用,流式细胞分析仪需具备一个发射的光在激发光谱范围内的激光器(最好接近峰值或最大激发波长),并能够选择性地检测发射光谱中的光(同样,最好接近发射曲线的峰值)。
荧光团的大小范围从小分子到大蛋白。一些荧光团作为细胞染料独立发挥作用,并结合细胞的特定组分。这些荧光团的示例是碘化丙啶或 DAPI(均为嵌入染料,在与 DNA 结合时会发出荧光)以及死活细胞鉴定染料(在固定之前区分标记活细胞和死细胞)。死活细胞鉴定染料使研究人员能够从分析中排除死细胞,即使在细胞已经固定并随后用胞内靶标抗体标记之后。
蛋白荧光团(例如 GFP)是独一无二的,因为它们可以被 DNA 编码。通过将 GFP 的 DNA 序列添加到编码特定蛋白的 DNA 序列上,研究人员能让细胞产生带其自身荧光标签的蛋白。从而能够直接分析体外和体内系统中的蛋白位置和数量,无需后续标记操作。也可以在特定细胞类型中或在特定条件刺激下选择性表达 GFP 等荧光蛋白。使用荧光标记物让某些细胞进行“自我报告”的能力提供了选择性计数和/或分选这些细胞的机会。
通常,在流式细胞术实验中用于获取读数的荧光团会与抗体共价结合。该过程称为偶联,并且该抗体-荧光团配对称为偶联物。当在一项细胞检测中使用偶联抗体时,荧光团发射的光可作为细胞内或细胞上存在的抗体量的一个直接指标。(由于细胞膜是透光的,细胞内荧光团发射的光不会显著衰减。)通过使用特异性结合蛋白或蛋白修饰的偶联物,研究人员可以根据每个细胞发射的荧光水平,直接量化该细胞中的目的靶标。该过程称为直接检测或直接流式细胞术。
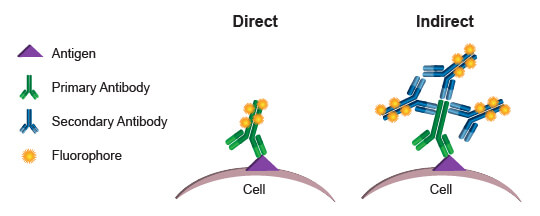
替代方法,即间接流式细胞术,利用针对生成一抗的宿主中的免疫球蛋白的二抗。在这种方法中,二抗与荧光团偶联,留下未修饰的一抗。当一抗偶联可能会导致影响特异性和功能的空间变化时,这类实验步骤可能优于直接流式细胞术。当需要增加信号时,也可首选这类实验步骤。多个二抗可结合一个一抗,从而扩大一抗所结合的每个抗原分子所衍生的信号。间接流式细胞术的一个缺点是,可在一个实验中结合的抗体数量有限。每种一抗都必须在不同物种(如兔、山羊或小鼠)中孵育,以使二抗具有特异性检测功能。例如,在同一实验中不能使用来自小鼠的两种一抗,因为抗小鼠二抗会标记这两种一抗,从而无法单独区分每种抗体的荧光贡献。
通常首选直接流式细胞术,因为它免除了需要二抗时所需的额外步骤。更重要的是,它能够在一种检测中同时使用许多不同的抗体,限制因素变为流式细胞分析仪能够激发和差别性定量的不同荧光团的数量。通过将更多读数合并到一项检测中,研究人员能最大化所收集的信息量,并更深入地了解存在的细胞群。采用珍贵或有限样品时,同时收集多参数数据的能力(而不是单独运行每种抗体)可能是无价的。
| 流式细胞术的直接与间接染色 | |
|---|---|
| 直接:直接偶联抗体 |
|
| 间接:非偶联一抗 + 偶联二抗 |
|
具有独特光谱的特异性明亮荧光团的开发增加了流式细胞术的效能和实用性。窄而独特的光谱使在同一实验中分离来自多个荧光团或染料的信号变得更轻松,从而同时检测更多的目的分子。为了成功使用多色流式细胞术,面板设计必须要考虑到每个实验中所结合的荧光团的固有性质以及流式细胞分析仪过滤和区分那些荧光团的能力。
在多色流式细胞术中,荧光团的发射光谱会互相渗透。这种渗透称作光谱重叠,这意味着一些被检测到并归因于一个荧光团的光线实际上完全来自另一个荧光团(如下图所示)。如果不考虑此因素,该信号可能导致生物系统或实验结果的误解。校正此光谱重叠的过程称为“补偿”。补偿包括根据一个特定荧光团来确定发送到“错误”检测器的光量,然后减去每个受影响检测器报告的数值。可以通过单独运行每个荧光团和测定每个检测器中的光,或者通过运行“荧光减一”实验(在此实验中,每次减一个荧光团)来确定渗透量。然后,补偿包括根据所有染料的已知贡献来对检测到的光进行数学校正。例如,假设通常由检测器 #1 测定的荧光团信号中有 5% 正在通过检测器 #2 进行定量。然后通过计算检测器 #1 报告的信号的 5% 并减去检测器 #2 报告的信号百分比,补偿将适用于每个细胞。必须对每个细胞都应用这种方法,因为每个细胞具备的来自存疑荧光团的信号量各不相同。取决于流式细胞分析仪,颜色补偿可以通过定义特定荧光控制自动计算,或者在采集数据后手动应用。
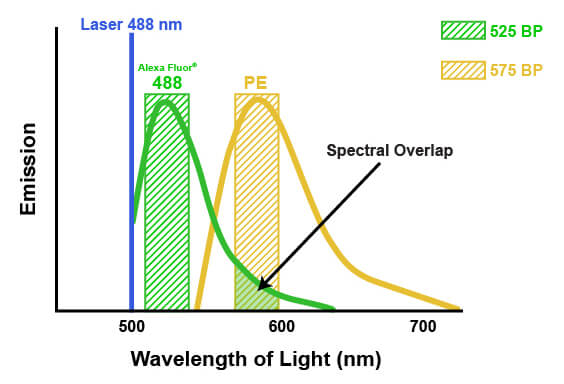
在单个实验中结合多种抗体时,需要进行适当的面板设计来确保生成可用数据。建议搭配使用最亮的荧光团与结合最低丰度抗原的抗体。在系统内有背景噪声的情况下,这会增强细胞分析仪准确检测和量化来自抗体的信号的能力。其次,应选择具有不同激发波长或广泛分离的发射光谱的荧光团,以最大程度地减少光谱重叠。这将确保可区分来自各抗体的荧光,并减少或补偿需求。随着面板中抗体数量的增加,维持光谱分离变得更加困难。
串联染料(例如 APC-Cy®7、PerCP-Cy®5)的使用可进一步增加在单个实验中使用的颜色数量。一般来说,串联染料会增加激发波长和发射波长之间的位移。从而允许在荧光团的激发波长相同的情况下,使用更多抗体。串联染料使用一种称作荧光共振能量转移 (FRET) 的效应。在 FRET 期间,第一个荧光团在特定波长时被激发,并且在达到其最大能量状态时,能量被转移到第二个荧光团上,从而导致第二个荧光团的光子发射波长比单独从第一个荧光团获得的要大。PE 和 APC 均广泛用于生成与各种花菁染料联合使用的串联染料,例如 Cy®5 或 Cy®7。
使用串联染料进行颜色补偿可能更具挑战性,并且在应用不当时,可能会导致伪影。适当的补偿控制将会降低实验中误解数据的风险。
针对流式细胞分析进行的样品制备是一个关键步骤,并且需要针对每种检测或抗体进行优化。一般来说,抗体结合目的分子的效率很大程度上依赖于实验步骤的条件(例如,固定和通透方法)。最佳实验步骤可能是细胞内分子位置、表位确认和可访问性,以及抗体结合非预期表位的潜力的一个函数。
针对细胞分析且基于抗体的标记方法大体上可分为细胞表面或胞内抗原染色。虽然细胞表面染色可以在活细胞上进行,但胞内染色需固定和通透细胞。固定可确保在固定时保持细胞状态,防止在标记和分析细胞的整个过程中发生变化。一种常见且有效的固定剂是甲醛,其通过蛋白交联进行固定,而细胞膜仍完好无损。进行通透以使抗体能够通过细胞膜,从而结合胞内分子。通透剂的选择对于检测中使用的抗体的特异性和功能具有显著影响。通常使用甲醇等溶剂或 Triton X-100 或皂素等去垢剂实现通透。使用皂素进行的通透最不彻底;它通过结合胆固醇在质膜中形成孔道,但不会通透胞内膜结构,例如核膜或线粒体膜。Triton X-100 和甲醇能够充分通透大多数胞内膜,从而提供最彻底的通透。然而,甲醇可能会破坏表位,一些抗体(包括一些表面标记物)在进行甲醇通透后不起作用。
一些抗体在各种固定和通透条件下均起作用,而另一些则需要一套有限的试剂才能正确进行结合。这必须根据经验确定,在一种新实验步骤中使用一种抗体时,应进行仔细测试。
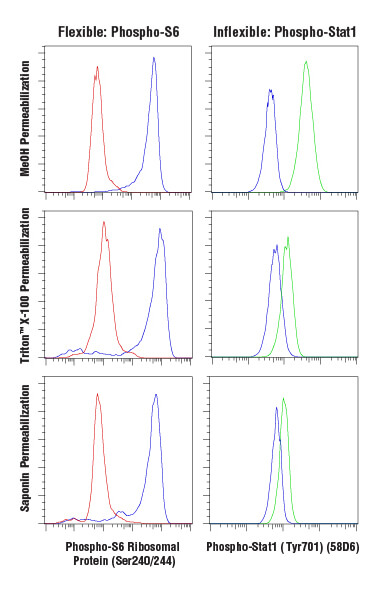
在固定和通透后,可以用经稀释的一抗来孵育细胞,从而对细胞进行染色,然后在分析之前进行洗涤步骤并重悬细胞。表面和胞内染色可以在固定和通透之后进行合并,前提是标记表面蛋白的抗体适合该实验步骤。
与所有实验一样,适当的控制对采集数据的正确解读至关重要。控制可以表明治疗的疗效、样品之间的差异、正确的颜色补偿以及背景信号的水平,举几种常见用途来说。测定背景或自发荧光的水平可确定抗体贡献的真实信号。
可以通过使用未染色的细胞或通过使用同工型抗体来确定背景信号的水平。同工型是结合域不靶向细胞中的任何分子的抗体,但其恒定区(非结合域)与实验中使用的抗体类型一致(例如兔 IgG 抗体)。同工型对照物应与同一荧光团偶联以作为实验抗体,从而实现直接比较。同工型针对该类别的蛋白可能发生的结合提供估计;例如,细胞表面分子可与兔 IgG 抗体的恒定区相结合。
虽然同工型可提供非预期结合的数量的估计值,但它们并不是实验中使用的抗体特异性的一个指标。抗体特异性可通过比较在已知阳性条件下(例如,内源性表达、过表达、诱导蛋白修饰的处理)获得的荧光与在已知阴性条件下(例如,敲除、内源性阴性、抑制蛋白修饰的处理)获得的荧光来确定。抗体特异性应使用将用于进行实验的同一实验步骤来确定。
在多色实验中,用于正确估计背景上方信号的一种重要控制是荧光减一 (FMO) 控制。通过在除 1 外的面板中添加所有抗体来生成 FMO 控制。通过分析“空”通道中的残余荧光,研究人员可以更准确地绘制门控以确定阳性信号与背景的位置。虽然针对面板中的每种抗体都可以运行 FMO 控制,但对于与面板中的其他颜色明确分开的荧光团,可能不需要这种控制。
补偿控制将在多色实验中实现适当的荧光补偿。这通常包括一次分析标有 1 个荧光团的细胞,以确定出现在用于检测荧光团之外的通道中的渗透量。在控制中测得的荧光信号的强度应与在实验本身中观察到的荧光信号的强度相同。这确保每个检测器的增益(电压)设置与实验设置相匹配,因为这些增益的变化将会改变所需的补偿。
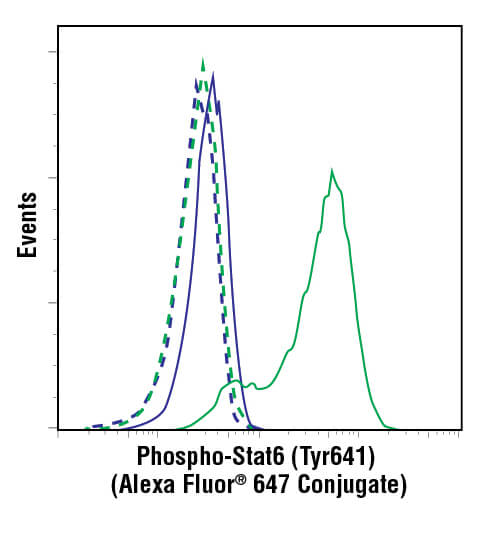
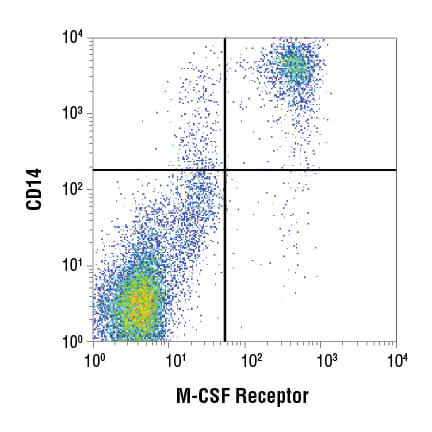
流式细胞术数据通常用两种方法中的一种来显示:散点图和直方图。散点图,也称点阵图(如下图所示),可同时显示两个参数,每个参数沿轴缩放。这是用于评估两个读数之间的关联性的一个强大可视化工具,常用于显示细胞群的光散射或荧光特性。
直方图(如下图所示)用于一次显示 1 个参数,读数沿图的 x 轴缩放。y 轴显示发生频率,或沿 x 轴的每个点检测到的细胞数。通常,此显示用于评估细胞群的荧光强度。
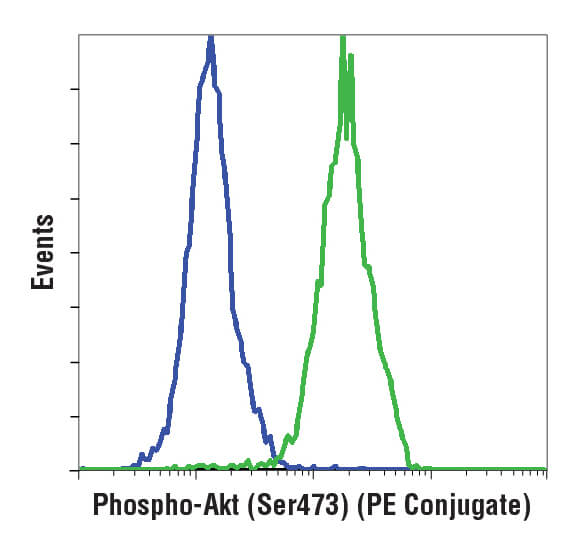
了解如何解读直方图和散点图对进行流式细胞术数据的分析是必要的。
流式细胞术实验最重要的步骤之一就是数据分析。该步骤可能充满挑战性,尤其是在用户面临大量数据的复杂实验中。虽然流式细胞分析仪有利于针对每个细胞提供许多数据点,但是认识和理解每个读数所表示的意义对于避免数据操作或解读错误至关重要。这很重要,因为用户无法真正地观察细胞,而必须依靠流式细胞分析仪提供的数值集来确定。将此技术与以下检测进行比较,例如蛋白印迹法、免疫荧光细胞的显微镜分析或石蜡包埋组织上的免疫组织化学染色。在这些检测中,直接可视化分析让人们能够直观地了解分析样本的质量、检测中使用的抗体的特异性,以及更好地理解哪些数据要保留或放弃。
正确利用流式细胞术中的每个读数,可使用户能够进行强大的逐步分析、深入了解目标细胞群,并获得这些细胞生物学方面的具体见解。这通过流式细胞术数据分析中的基本工具之一来实现:门控。
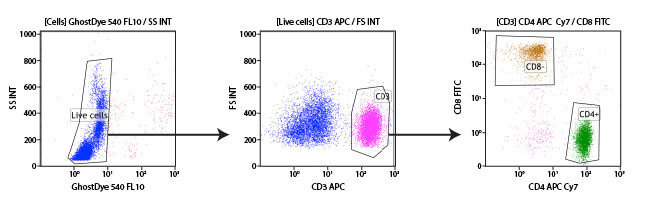
设门是一种数据分析方法,用户凭借此方法可以选择流式细胞分析仪在实验中记录的目标亚群,从而独立于整个细胞群来分析该亚群。几乎所有实验中都会进行设门,以便排除分析中不需要的细胞碎片或团块,或获得异质样品内各细胞类型的度量标准。大多数流式细胞分析仪软件通过使用户能够在散点图或直方图上绘制门控,从而实现轻松设门。因此,用户可选择他们想要用于检测某个特定目标亚群的读数,例如,仅在该亚群上表达的 CD 标记。虽然门控是使用一个样本创建的,但是它可重复应用于一个实验中的所有样本,并可进行保存以供多个实验使用。这使研究人员能够以一致的方式来选择特定细胞群。
还可以进行子级设门。例如,研究人员可以首先创建一个使用散射特征的门控来仅选择单细胞(从分析中排除双联体和细胞团块)。这个单细胞群现在可以在第二个散点图上显示,并进一步选择显示指示 CD3 蛋白的强荧光的细胞。这些“CD3 阳性”细胞是 T 细胞,这个亚群现在可以在进一步的散射图上显现,并分解成 CD4 和 CD8 阳性细胞群,循环 T 细胞的两种主要组分。对于通过某个门控定义的每个细胞群,用户都能够获得数据,包括细胞计数、荧光平均值和其他指标。
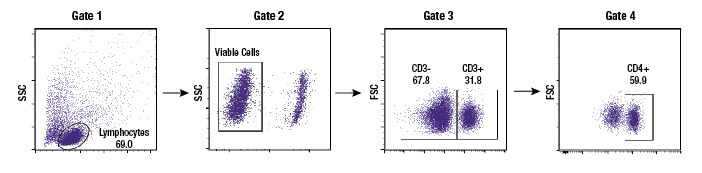
一旦在流式细胞仪上对某个细胞群设置了门控或进行了检测,一个基本的指标就是在定义的细胞群中存在的细胞数量。然后,该细胞群的大小可以作为细胞计数进行报告,或者可以表示为相对于该样本中获得的细胞总数的百分比。通常,细胞的百分比将从多个门控内部进行报告,并且这些门控会在分析中显示,以便其他人能够理解研究人员实际上如何划分一个细胞群和另一个细胞群之间的界线。门控的显示和每个门控中细胞的百分比在说明细胞从一种状态转变至另一种状态以响应治疗时极其有效。
通过光电二极管或光电倍增管采集的数据显示为称为荧光强度的无量纲数字。无任何单位与强度有关,因此,这些数字仅用于在实验中提供相对比较。仪器与仪器之间,或者甚至实验与实验之间的荧光值都无法进行比较,除非运行某种让人们能够了解这些值如何关联的标准。
为了得出结论或描绘某细胞群的特征,针对该细胞群计算的荧光强度通常报告为平均荧光强度或中位荧光强度(缩写为 MFI)。该平均值为用户提供了特定实验中所分析的所有细胞的荧光强度的平均值。这个值强烈受到异常值的影响,因此不被视为一个可靠的衡量标准(除非有意确保考虑到异常值)。中位荧光强度也要进行报告,并且是一种更加可靠的评估,因为它不会强烈受到偶尔的异常值的影响。